一、前言
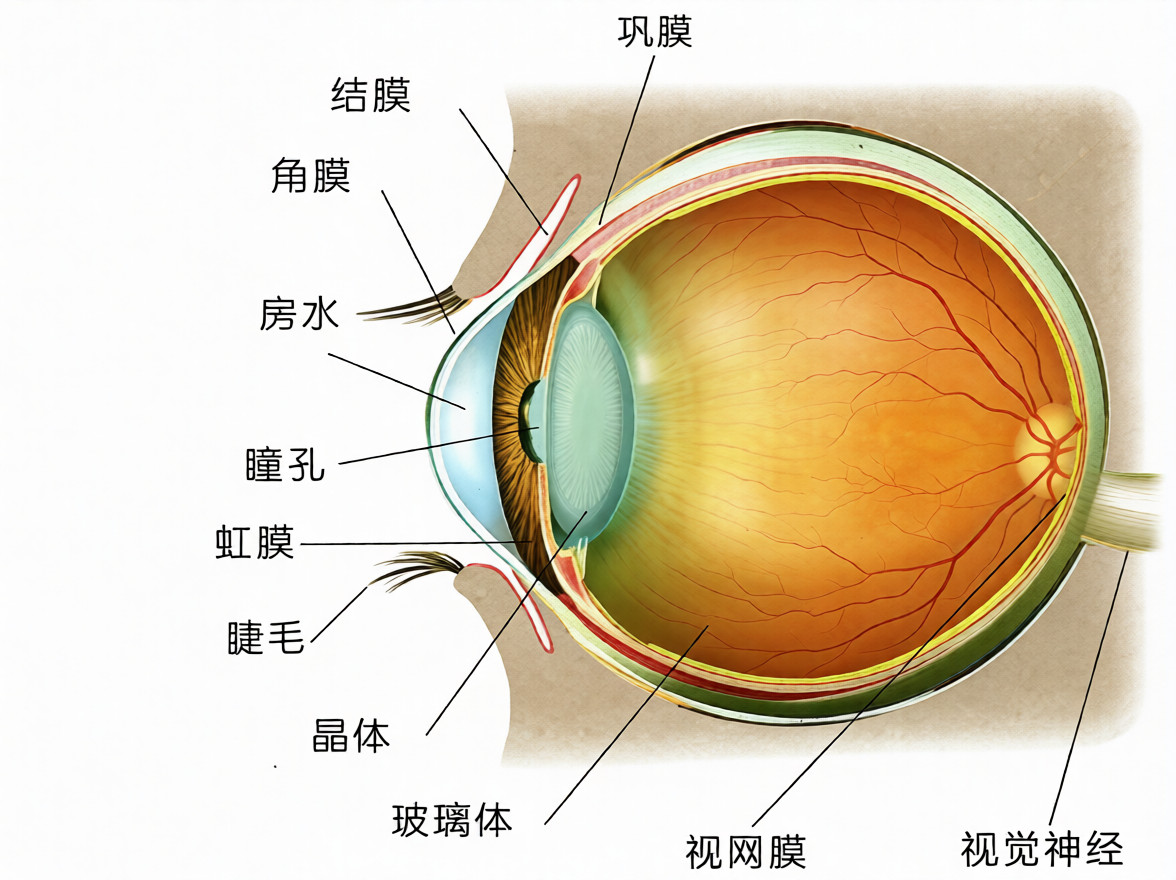
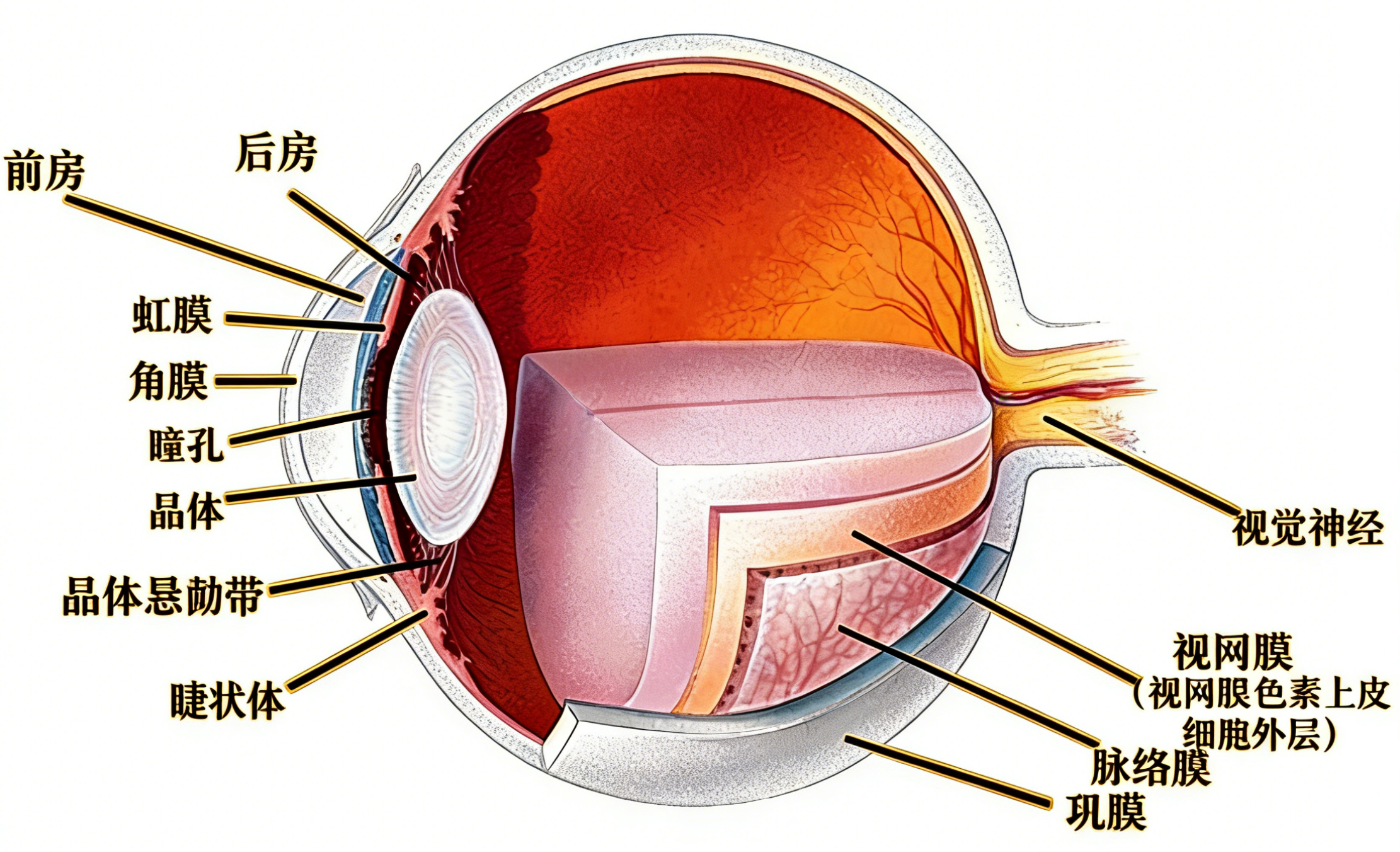
房水是填充于眼球前房及后房内的无色透明液体,其成分与血浆超滤液相似,但存在独特的动态平衡。作为与血液、淋巴液并列的体液之一,房水直接与晶状体、角膜内皮、小梁网等重要眼内组织接触,其内含的蛋白质、代谢产物、细胞因子、抗体等物质浓度变化,能够灵敏地反映眼前节乃至眼内局部的病理生理状态。因此,对房水样本进行多因子检测,已成为探索眼部疾病发病机制、寻找特异性生物标志物、评估疾病活动性与治疗反应的重要研究手段。规范化的样本采集、处理与保存流程,是确保后续检测数据准确性与可比性的基石。
二、样本取样流程
房水样本的获取属于侵入性操作,必须在严格的无菌条件下,由具备资质的眼科医师在手术室或专门的治疗室内进行。操作需遵循医疗伦理规范,术前获得患者的知情同意。
2.1 术前准备
患者取仰卧位,术眼按常规眼科手术要求进行消毒铺巾。通常采用表面麻醉(如盐酸丙美卡因滴眼液)即可完成麻醉。选择合适的穿刺针,最常用的是结核菌素注射器配套的27G或30G针头,其容量小、管径细,有利于精确控制抽取量并减少组织损伤。
2.2 穿刺部位与操作
穿刺点通常选择在颞上方或鼻上方角膜缘内0.5-1.0毫米的透明角膜处,该区域血管稀少,可减少出血风险。助手可用无菌棉签或镊子在对侧固定眼球。术者以垂直于角膜切线方向的角度缓慢进针,针尖斜面朝上,进入前房深度约2-3毫米,可见针尖位于虹膜前方。切忌穿刺过深,以免损伤虹膜或晶状体。
2.3 样本抽取
缓慢平稳地回抽注射器活塞,抽取所需体积的房水。通常情况下,用于多因子检测的房水抽取量为50-150微升。抽取过程需极其轻柔,避免负压过大导致虹膜被吸附于针口或引起前房塌陷。抽取完毕后,同样缓慢地将针头沿原路退出,穿刺口常可自行闭合,无需缝合。术后可局部涂抹抗生素眼膏并包扎。
2.4 注意事项
操作应避免接触虹膜组织,以防房水中混入血液或色素细胞。若发生微量出血,应暂停操作,待血细胞沉降后再于清澈区域重新取样,或放弃该样本。样本中若肉眼可见血液污染,原则上不应用于后续检测。
三、样本的预处理与分装
样本抽取后应立即处理,以大程度保持各因子的生物活性。
3.1 转移与分装
在无菌超净工作台内,将注射器中的房水样本缓慢注入预冷的、不含内毒素的微型离心管(如0.5毫升离心管)中。鉴于房水量极少,建议根据后续检测项目需求,在抽取后立即进行分装。例如,计划进行细胞因子阵列、蛋白质组学、代谢组学等不同平台检测时,应在首次转移时就分装至多个独立试管,避免反复冻融。
3.2 离心处理
根据研究目的决定是否离心。若检测目标为可溶性因子(如细胞因子、趋化因子、抗体、代谢物),建议在4°C条件下,以1000-2000×g的离心力离心5-10分钟,取上清液进行分装。此举可沉淀可能存在的少量细胞或碎屑,提高检测的准确性。若需分析房水中的细胞成分,则需单独处理细胞沉淀。
四、样本保存与运输条件
房水样本中许多生物活性物质不稳定,对温度极为敏感,规范的保存与运输是保证检测质量的关键环节。
4.1 短期保存
预处理后的房水样本如计划在24小时内进行检测,可暂时保存于4°C冰箱。但需注意,部分细胞因子降解速度较快,即使低温下亦会随时间推移而浓度下降,因此应尽快检测。
4.2 长期保存
对于需要长期保存的样本,应立即进行低温冷冻。推荐采用梯度冷冻法:先将分装好的样本置于-20°C冰箱1-2小时,然后转移至-80°C超低温冰箱长期保存。此法可减少因冰晶快速形成而造成的蛋白变性或细胞损伤。房水样本在-80°C条件下,多数蛋白质和细胞因子可稳定保存数月乃至数年。应严格避免反复冻融,反复冻融会导致大分子降解、蛋白聚集和活性丧失,原则上每个分析物冻融周期不应超过一次。
4.3 运输条件
如需将样本转运至中心实验室,必须使用专业的低温运输设备。干冰(固态二氧化碳,约-78°C)是维持-80°C低温环境的常用介质。运输前需将样本用密封袋包裹严密,置于装有足量干冰的专用保温箱中,确保运输全程样本处于冰冻状态。同时,应详细记录样本采集时间、预处理步骤、分装情况、冻存时间及运输起始时间,附随样本一同送达。
五、多因子检测的技术考量
房水样本体积微小、蛋白总浓度较低(约为血浆的1%),且目标因子含量可能极低,这对检测技术提出了高灵敏度、高特异性和微型化的要求。
5.1 检测平台选择
目前常用的多因子检测平台包括:
✔️液相芯片技术(如多重微珠阵列): 可在单次实验中同时检测数十种细胞因子/趋化因子,所需样本量少(通常仅需25-50微升),灵敏度高,是目前房水多因子检测的主流技术。
✔️电化学发光免疫检测: 具有更宽的动态检测范围和极高的灵敏度,适合检测浓度跨度大的因子组合。
✔️蛋白质组学方法: 如基于质谱的标记或非标记定量技术,可用于无偏倚地发现和定量房水中数千种蛋白质,是探索性生物标志物研究的有力工具。
✔️特定因子ELISA: 当目标因子数量较少或需绝对定量时,传统ELISA仍是可靠选择,但需消耗相对较多的样本体积。
5.2 数据校正与质控
由于房水样本无法通过常规方法精确测定总蛋白浓度进行均一化校正,常采用以下策略进行数据标准化:
👉体积校正: 直接以单位体积(如每毫升)的浓度呈现。
👉内参蛋白校正: 选用房水中表达相对稳定的蛋白(如白蛋白)作为内参进行校正。
👉样本特异性质控: 在检测板中设置标准品曲线、空白对照、质控品,并评估样本的加标回收率,以监控检测系统的性能。对于低浓度样本,报告时应注明是否低于检测下限。
六、结语
房水样本的多因子检测为深入理解眼部疾病的分子机制打开了重要窗口。其价值高度依赖于从采样到分析全链条的标准化与规范化。严谨的操作流程、即时的预处理、严格的低温保存与运输,是确保这份珍贵微量样本中生物信息真实、完整传递的前提。随着检测技术的不断进步,对房水“微环境”的精准解析,必将为眼科疾病的精准诊断、治疗靶点发现及疗效监测提供更为坚实的科学依据。未来研究应致力于建立更广泛的房水成分参考区间,并探索其与循环系统生物标志物的关联性与差异性。
七、房水用来做细胞因子检测,哪个公司有?
LabEx为您提供专业、高灵敏度的房水样本细胞因子检测服务。房水作为直接反映眼内微环境的关键生物样本,其细胞因子与趋化因子的精准分析,对于探究眼部炎症、免疫反应及多种眼科疾病的病理机制至关重要。我们采用经过特殊优化的高灵敏度检测平台(如多重液相芯片Luminex或电化学发光法),能够对微量房水样本中低丰度的关键炎症因子、血管生成因子等(如IL-6、IL-8、VEGF、MCP-1等)进行准确定量。
| 货号 | Panel名称 | 种属 | 检测指标 |
| LXLBH15-1 | 人Th17细胞-15因子Panel | Human | IFN-γ,IL-10,IL-17F,IL-23,IL-4,IL-6,TNF-α,IL-17E/IL-25,IL-33,IL-31,IL-21,IL-22,IL-17A,IL-1β,sCD40L |
| LXLTM36-1 | 小鼠细胞因子/趋化因子-36因子Panel | Mouse | GM-CSF,IFN gamma,IL-1 beta,IL-2,IL-4,IL-5,IL-6,IL-12p70,IL-13,IL-18,TNF alpha,IL-9,IL-10,IL-17A (CTLA-8),IL-22,IL-23,IL-27,G-CSF (CSF-3),IFN alpha,IL-3,IL-15/IL-15R,IL-28,IL-31,IL-1 alpha,LIF,ENA-78 (CXCL5),M-CSF,Eotaxin (CCL11),GRO alpha (CXCL1),IP-10 (CXCL10),MCP-1 (CCL2),MCP-3 (CCL7),MIP-1 alpha (CCL3),MIP-1 beta (CCL4),MIP-2,RANTES (CCL5) |
| LXLTH34-1 | 人细胞因子/趋化因子-34因子Panel | Human | GM-CSF,IFN gamma,IL-1 beta,IL-2,IL-4,IL-5,IL-6,IL-8,IL-12p70,IL-13,IL-18,TNF alpha,IL-9,IL-10,IL-17A (CTLA-8),IL-21,IL-22,IL-23,IL-27,IFN alpha,IL-1 alpha,IL-1RA,IL-7,IL-15,IL-31,TNF beta,Eotaxin (CCL11),GRO alpha (CXCL1),IP-10 (CXCL10),MCP-1 (CCL2),MIP-1 alpha (CCL3),MIP-1 beta (CCL4),RANTES (CCL5),SDF-1 alpha |
| LXLBH27-1 | 人细胞因子-27因子Panel | Human | G-CSF,GM-CSF,IFN-γ,IL-10,IL-12(p70),IL-13,IL-17A,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-7,IL-8/CXCL8,MCP-1/CCL2,MIP-1β,TNF-α,IL-1Rα,IL-9,IL-15,FGF-basic,Eotaxin/CCL11,IP-10/CXCL10,MIP-1α/CCL3,PDGF-BB,RANTES,VEGF-A |