文献摘要:
阿尔茨海默病(AD)是老龄化社会中最常见的痴呆类型,其病理机制复杂且与正常衰老的界限模糊,给临床诊疗带来巨大挑战。前额叶皮层(PFC)是 AD 病理损伤的核心脑区,传统研究手段难以同步捕获其分子表达特征与空间分布信息。本研究采用亚细胞分辨率的 Stereo-seq 技术,构建 AD 患者与年龄匹配对照者 PFC 的空间转录组图谱,系统解析皮层分层结构紊乱、细胞类型特异性转录变化及细胞间通讯异常,筛选出关键调控因子与神经保护模块,为区分 AD 与正常衰老、开发新型治疗靶点提供突破性见解。
实验结果:
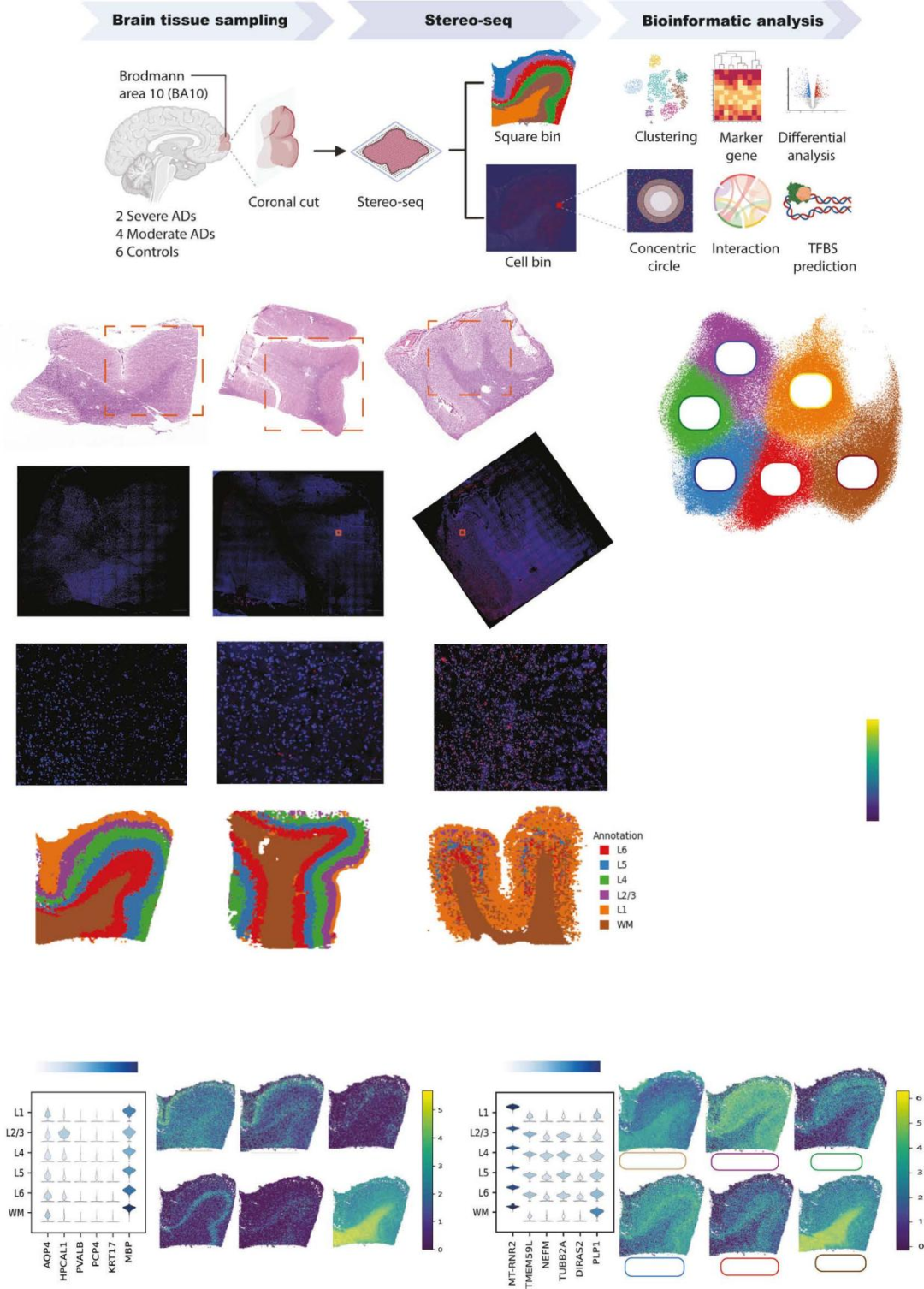
1、PFC 空间转录组图谱构建与皮层分层鉴定
本研究纳入 6 例男性 AD 患者及 6 例年龄匹配男性对照,统一采集前额叶皮层 BA10 区组织样本,建立标准化研究队列(图 1A)。免疫组织化学(IHC)染色明确病理差异:正常衰老(NA)组(B01809A3)几乎无 Aβ 斑块沉积,中度 AD 组(B01809C2)可见少量红色 Aβ 斑块,重度 AD 组(A02092E1)则表现为大量 Aβ 斑块聚集;无监督聚类结果与 H&E 染色组织学结构高度吻合,验证了分层鉴定的可靠性(图 1B)。UMAP 可视化分析清晰呈现 7 个聚类(L1-L6 + 白质 WM),直观反映不同皮层分层及白质区域的转录组差异特征(图 1C)。富集基因表达热图进一步量化各聚类的分子表达水平,为后续分层特异性分析奠定核心数据基础(图 1D)。本研究不仅验证了 AQP4(L1 层)、HPCAL1(L2/3 层)、PCP4(L5 层)等经典皮层分层标志物的空间表达模式,还新挖掘出 MT-RNR2(L1 层)、TMEM59L(L2/3 层)等未报道的层特异性标志物,丰富了 PFC 皮层分层的分子标识体系(图 1E、1F)
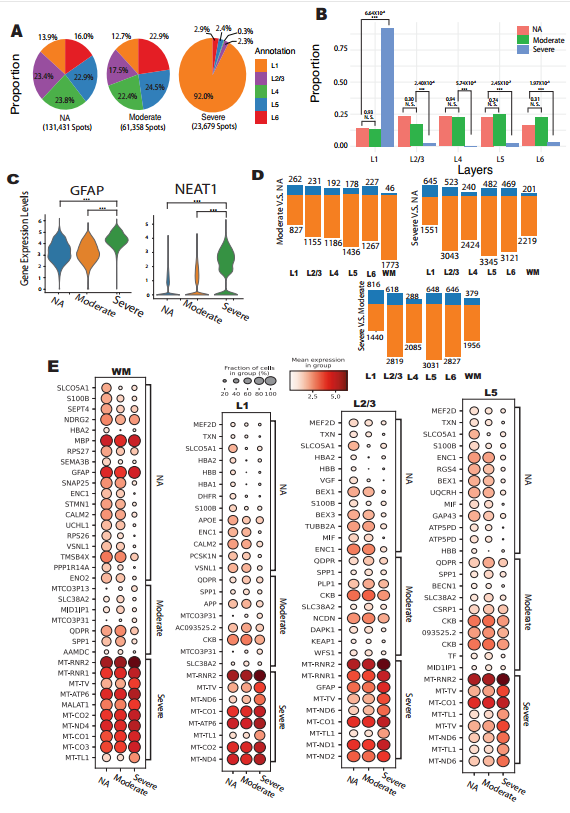
2、AD 进展中皮层分层结构紊乱与区域特异性转录异常
随着 AD 病情进展,皮层分层结构呈现显著紊乱:重度 AD 患者 L2-L6 层占比显著降低,L1 层占比由 13.9% 升至 22.9%,直观反映前额叶皮层的萎缩特征(图 2A-B)。星形胶质细胞激活标志物 GFAP 与 NEAT1 在重度 AD 组均呈高表达(校正后 P 值均为 0.0),提示 L1 层占比升高或与神经元降解及胶质细胞激活密切相关(图 2C)。差异基因分析显示,AD 组下调基因数量显著多于上调基因,且晚期上调基因多富集于线粒体功能相关通路,揭示 AD 进展过程中存在全局性线粒体功能障碍(图 2D-E)。值得注意的是,白质区域作为 AD 早期病变的敏感区域,在疾病早期即出现髓鞘维持基因 MBP、突触功能基因 SNAP25 的显著下调,提示白质病变可能是 AD 早期核心病理特征之一(图 2E)。
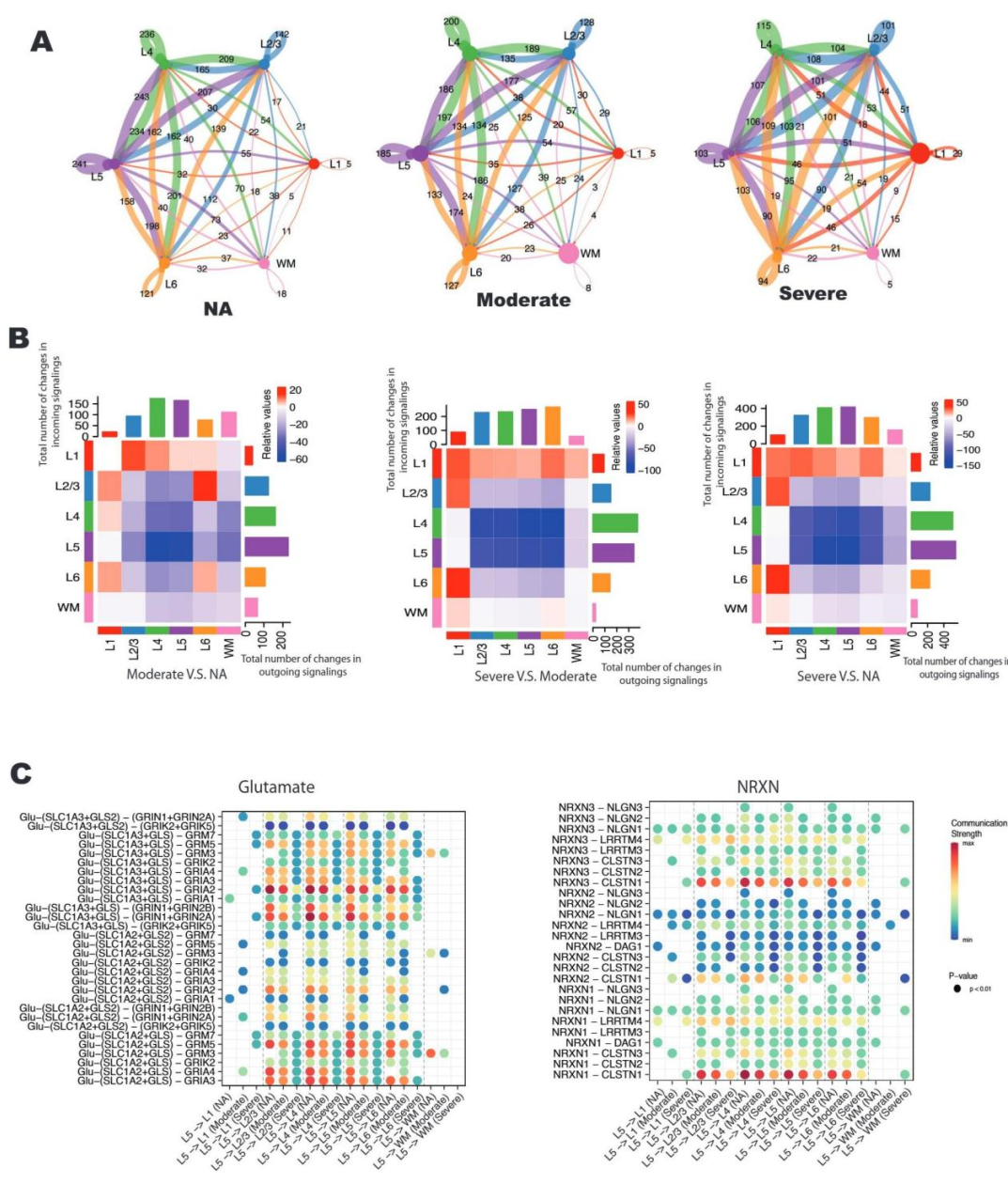
3、单细胞分辨率下高应激神经元的定位与特征鉴定
细胞通讯分析发现,AD 患者细胞间相互作用数量随病情进展持续减少,由正常衰老组的 3571 个降至重度 AD 组的 2244 个,直观呈现神经网络连接逐步崩溃的动态过程(图 3A)。热图对比结果显示,L4-L5 层间相互作用及 L4-L6 层信号输出显著减少;此类垂直网络是维持认知功能的核心结构,其破坏或直接诱发认知损伤(图 3B)。关键神经递质信号通路的损伤尤为显著:L5 层(主要输出层)向其他皮层分层传导的 SLC1A2-GRIA2(谷氨酸信号通路)、NRXN3-CLSTN1(突触分化相关)等核心配体 - 受体互作,在中度 AD 组显著减弱,至重度 AD 组则完全消失,这为认知衰退的分子机制提供了直接实验依据(图 3C)。
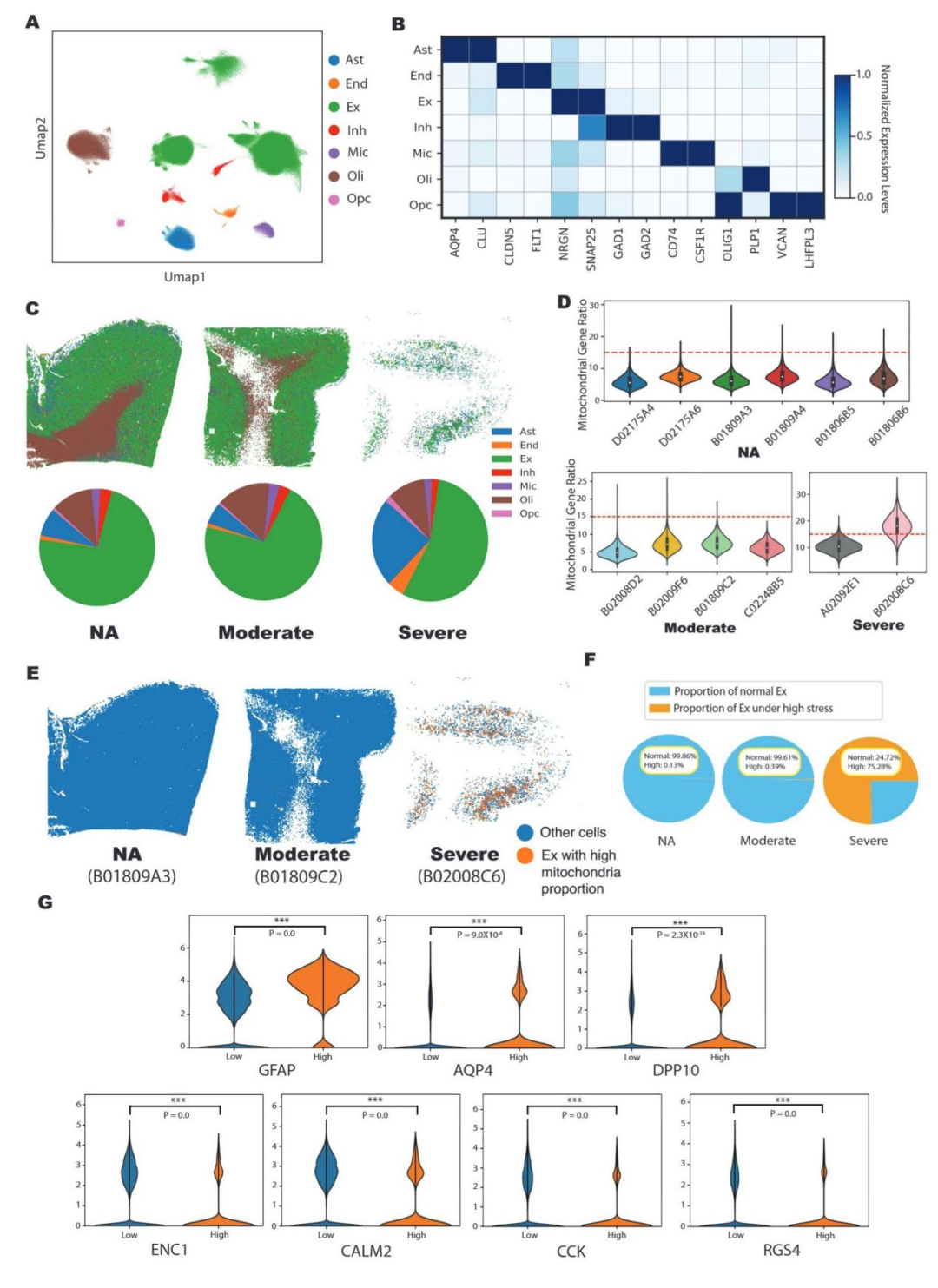
4、单细胞分辨率下高应激神经元的定位与特征鉴定
在 bin50 分辨率下,本研究注释出星形胶质细胞(Ast)、兴奋性神经元(Ex)等 7 类核心细胞类型,并明确 Ex 主要分布于新皮质、少突胶质细胞(Oli)富集于白质的空间分布特征(图 4A-C)。以线粒体基因占比≥15% 为判定阈值,研究鉴定出高应激 Ex 亚群:该亚群在重度 AD 组占比高达 75.28%,而正常衰老组仅为 0.13%,这一显著差异提示 AD 晚期神经元应激状态呈广泛性激活(图 4F)。高应激 Ex 所在区域同步高表达星形胶质细胞标志物GFAP、AQP4(校正后P值均为 0.0),表明神经元处于高应激状态时,邻近胶质细胞会被激活并向受损区域迁移,进而发挥潜在支持作用(图 4G)。差异基因分析进一步揭示高应激神经元的分子特征:MT-RNR2等线粒体相关基因表达上调,而ENC1、CALM2等神经保护基因表达显著下调(图 4G)。
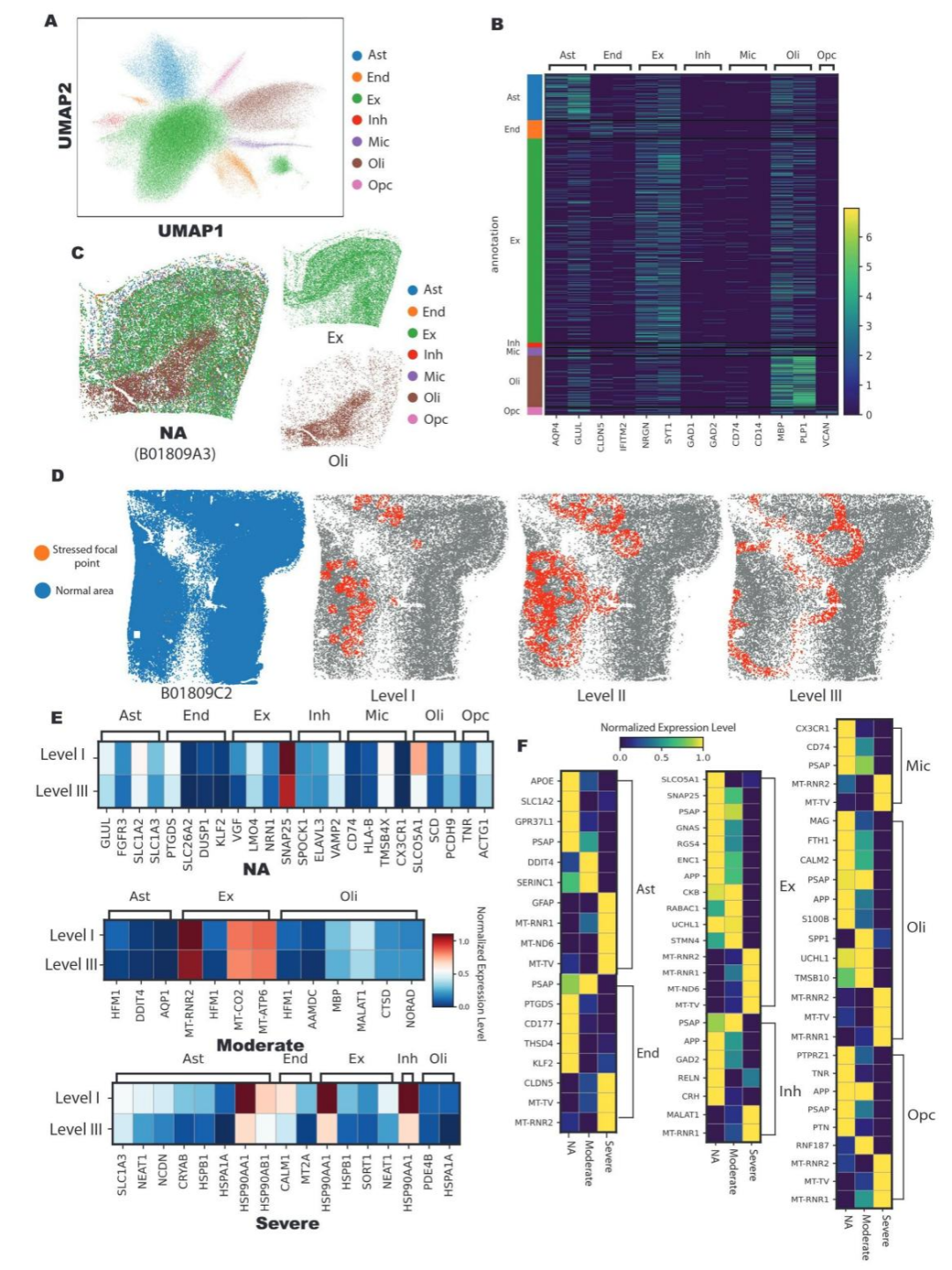
5、单细胞核水平的空间特异性转录应答与代偿机制
本研究首先对所有细胞核进行聚类分析(图 5A),并通过标记基因将其注释为兴奋性神经元、星形胶质细胞等主要细胞类型(图 5B),其空间分布与解剖结构高度一致(图 5C)。为解析细胞对 “高应激焦点” 的应答模式,研究以该焦点为中心,将周边细胞核按距离划分为三个同心圆层级(Level I 距离最近,Level III 距离最远)(图 5D),并基于此分组开展针对性分析。组内比较结果显示,正常衰老(NA)组中,紧邻应激焦点的神经元会特异性上调神经保护基因;而重度 AD 组中该调控模式完全消失,转而呈现热休克蛋白等全局应激基因的普遍性上调(图 5E)。组间比较发现,随着 AD 病情进展,即便处于最靠近应激焦点的前沿区域(Level I),各类细胞中 PSAP 等关键神经保护因子的表达也显著下调,提示其神经保护功能发生衰竭(图 5F)。
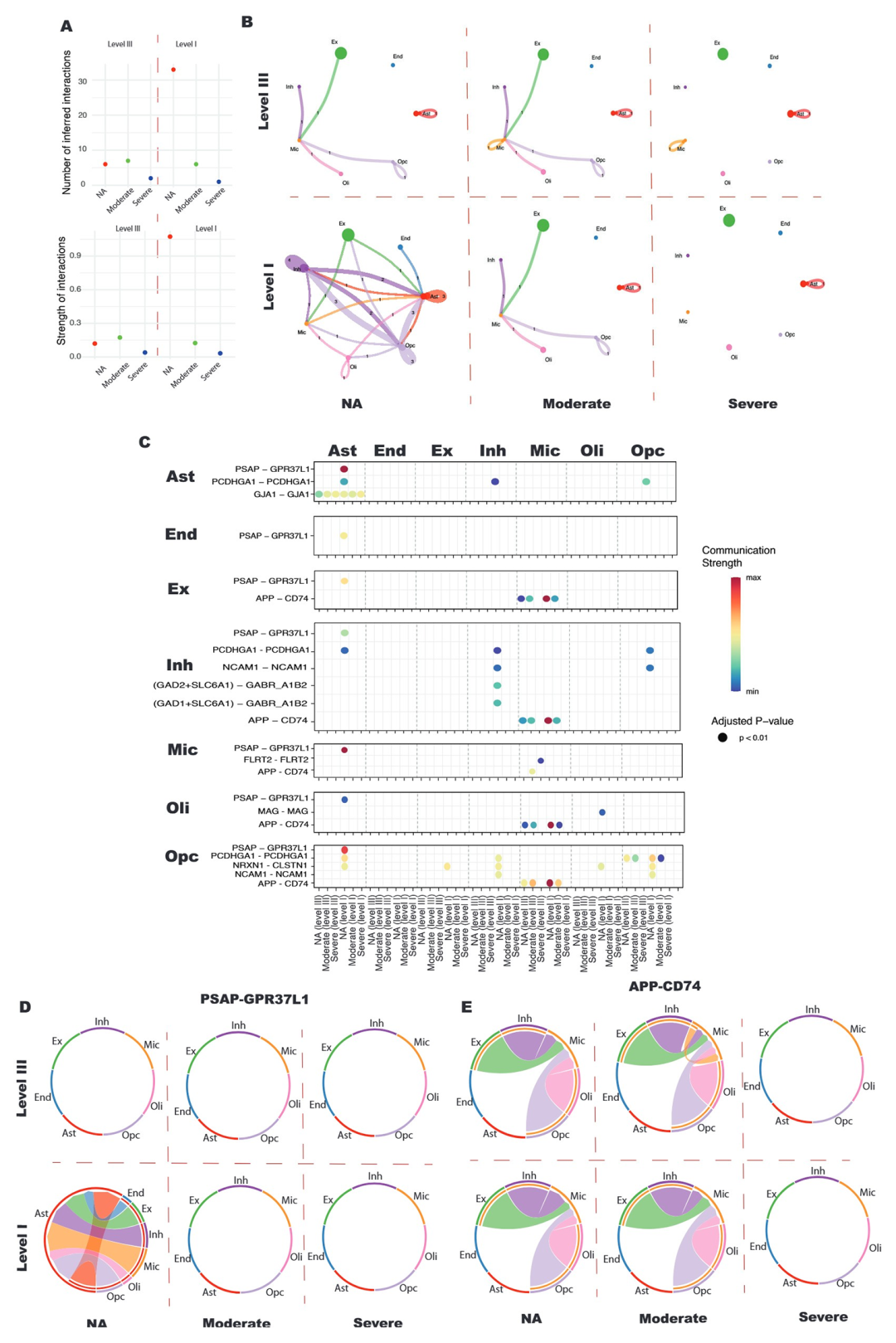
6、细胞间通讯网络破坏与 Aβ 清除能力下降
细胞间通讯分析显示,正常衰老组 L1 层细胞的配体 - 受体对数量及互作强度显著高于 L3 层,形成高效的保护性细胞互作网络(图 6A-B)。而 AD 组中,PSAP-GPR37L1(神经保护通路)、APP-CD74(Aβ 抑制通路)等核心配体 - 受体互作显著减弱甚至完全消失,直接造成神经保护功能与 Aβ 清除能力的双重受损(图 6C-E)。兴奋性神经元(Ex)与星形胶质细胞、小胶质细胞间的保护性互作,在重度 AD 阶段近乎完全断裂,这或为 Aβ 沉积加剧及神经元退行性降解的重要诱因(图 6D-E)。
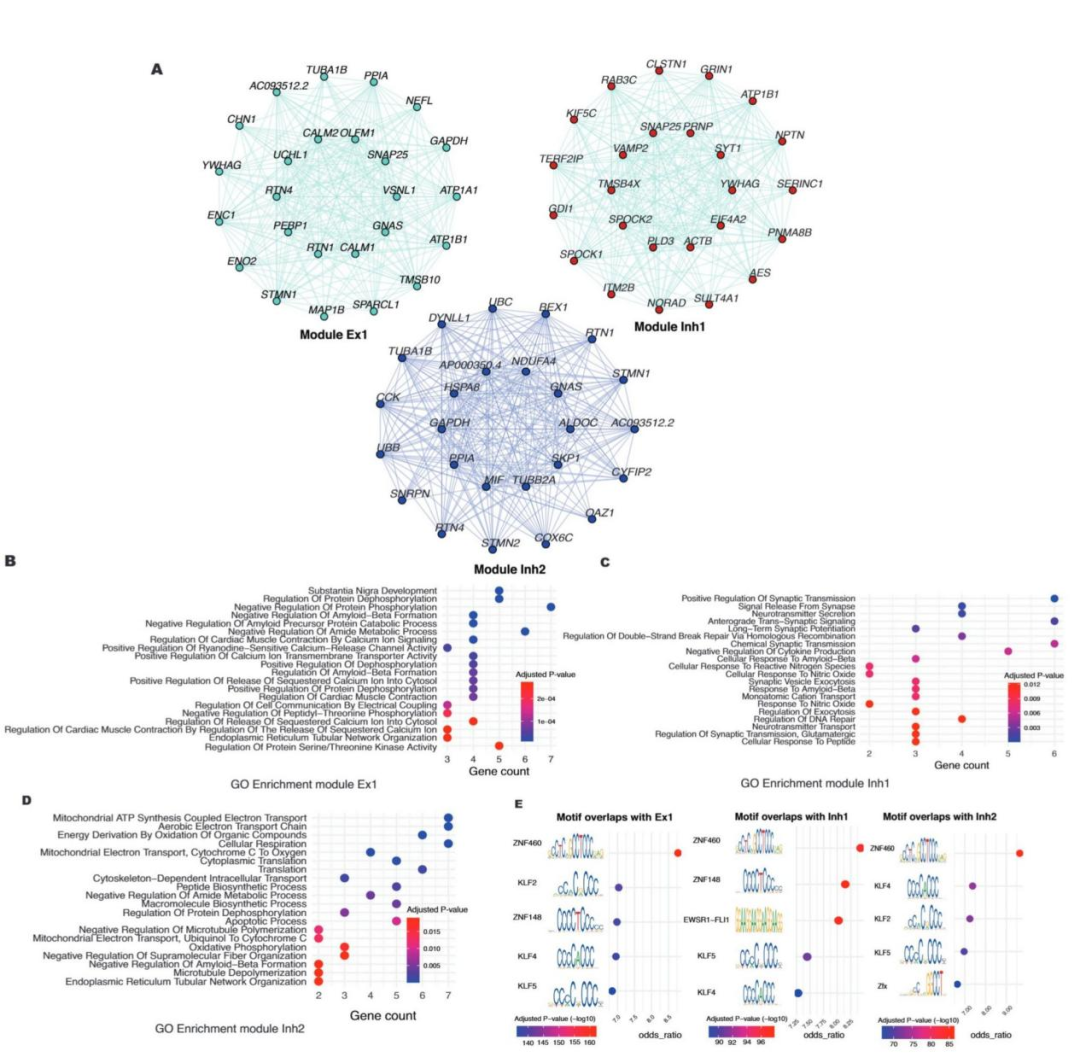
7、神经保护基因模块鉴定与关键转录因子筛选
通过加权基因共表达网络分析(WGCNA),本研究在兴奋性神经元(Ex)与抑制性神经元(Inh)中鉴定出 4 个核心基因模块(Ex1、Ex2、Inh1、Inh2),其中 Ex1、Inh1 及 Inh2 模块与 AD 病情进展呈显著负相关(图 7A)。GO 功能富集分析表明,这三个模块共同构成神经保护调控网络:Ex1 模块富集 Aβ 形成负调控、蛋白去磷酸化等功能,Inh1 模块参与突触传递调控及 Aβ 应答过程,Inh2 模块则与 Aβ 清除功能密切相关(图 7D)。转录因子富集分析显示,ZNF460 在上述三个核心模块中的富集程度最高,同时 KLF4、KLF5 等促 AD 进展转录因子亦在模块中富集,揭示了 AD 进展过程中复杂的转录调控机制(图 7E)。其中,ZNF460 作为核心转录调控因子,可能通过调控神经保护基因模块参与 AD 病理进程,为新型治疗靶点的开发提供了重要方向。
结论:
本研究依托 Stereo-seq 技术的高分辨率优势,结合明确的样本队列特征,首次在空间维度完整勾勒出 AD 患者前额叶皮层(PFC)的分子病理全景。通过图表对应分析,明确皮层分层结构紊乱、细胞应激水平升高、细胞间通讯网络塌陷及神经保护模块下调,是 AD 病情进展的核心病理特征。本研究不仅精准界定了 AD 与正常衰老的转录组差异,还发现以 ZNF460 为核心的关键调控网络,为解析 AD 发病机制提供了全新视角。这些研究发现将为 AD 早期诊断标志物的研发及精准治疗策略的制定提供重要支撑,为攻克这一神经退行性疾病注入新的希望。
乐备实(上海优宁维生物科技股份有限公司旗下全资子公司),是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫组化、DSP空间多组学等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。