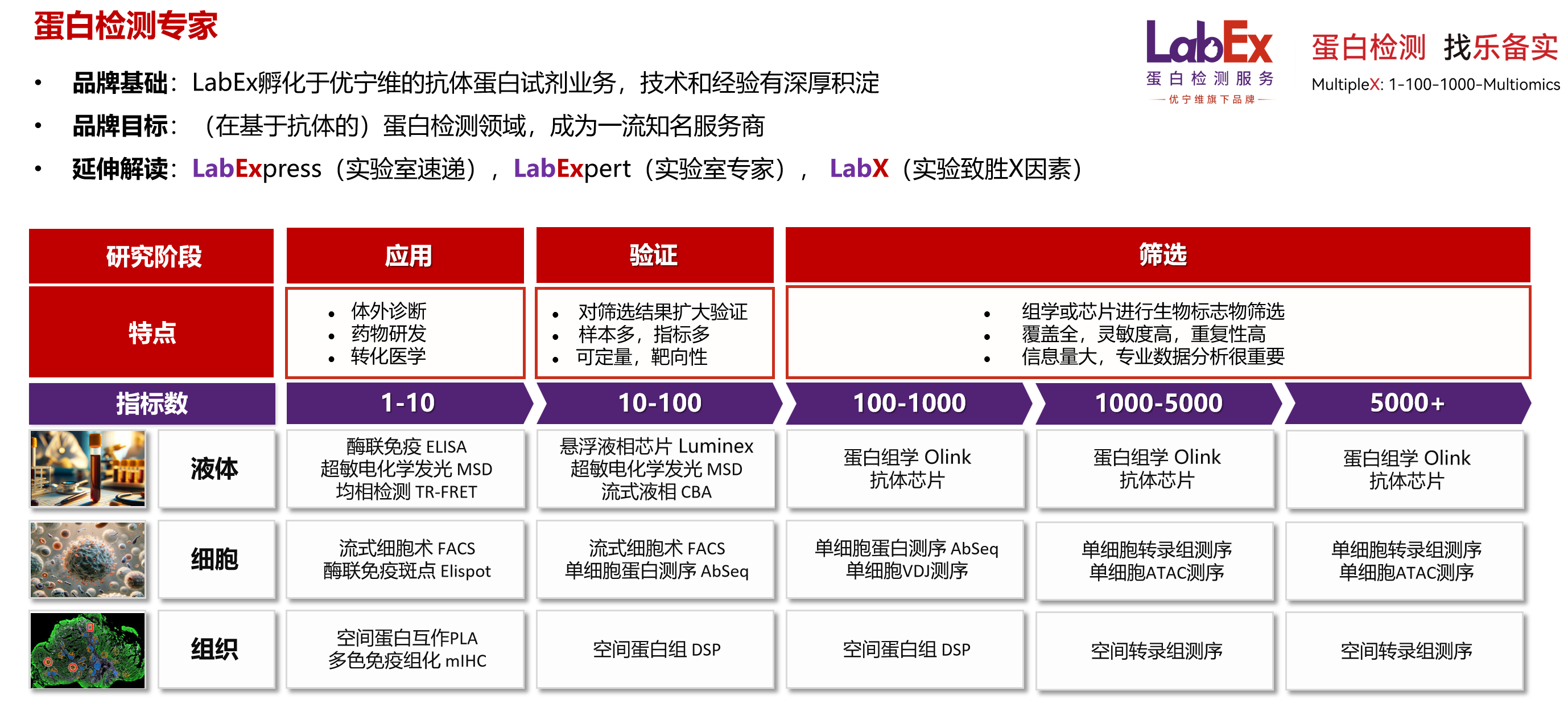
Bulk RNA-seq与单细胞转录组测序(scRNA-seq)的整合应用,已成为当前生命科学领域解析复杂生物学问题的核心研究策略。Bulk RNA-seq聚焦组织或细胞群体的整体表达水平,具备测序深度深、基因覆盖度广、数据稳定性高的优势,可高效获取样本全局转录组特征;scRNA-seq则突破群体平均表达的局限,以单细胞分辨率精准解析细胞异质性,清晰界定不同细胞亚群的转录组差异及功能特性。二者的协同联用可实现技术优势互补:Bulk RNA-seq为研究提供宏观转录组背景框架与核心表达趋势,scRNA-seq则完成目标基因或通路的细胞类型级精准定位,不仅能通过交叉验证提升实验结果的可靠性与重复性,更可从“群体-单细胞”双维度层层递进,深化对生物学过程调控机制的系统认知,为后续功能验证及转化研究筑牢数据根基。
💯方案设计
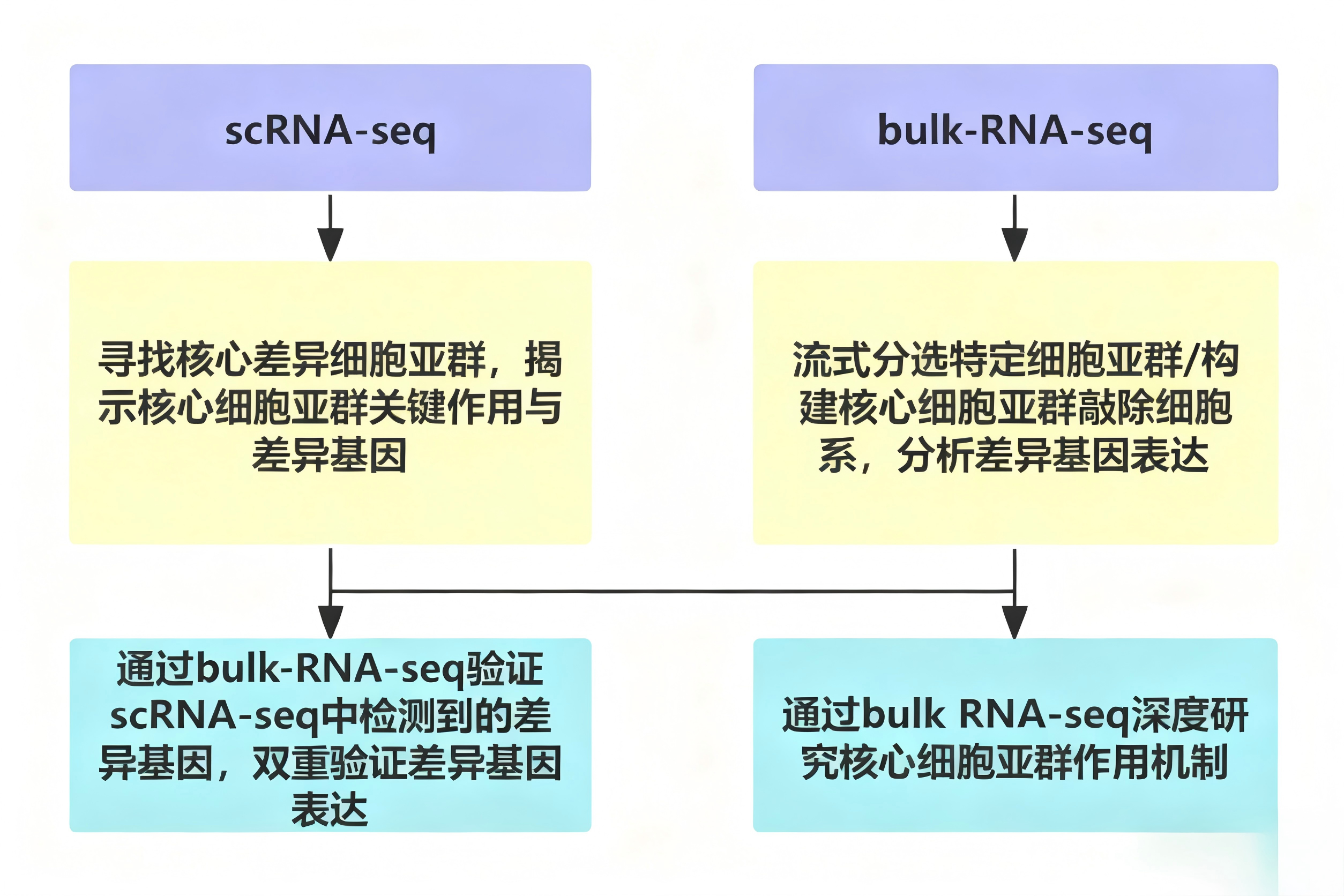
一、基于scRNA-seq挖掘的细胞类型特异性表达模式,通过Bulk RNA-seq进行群体水平验证
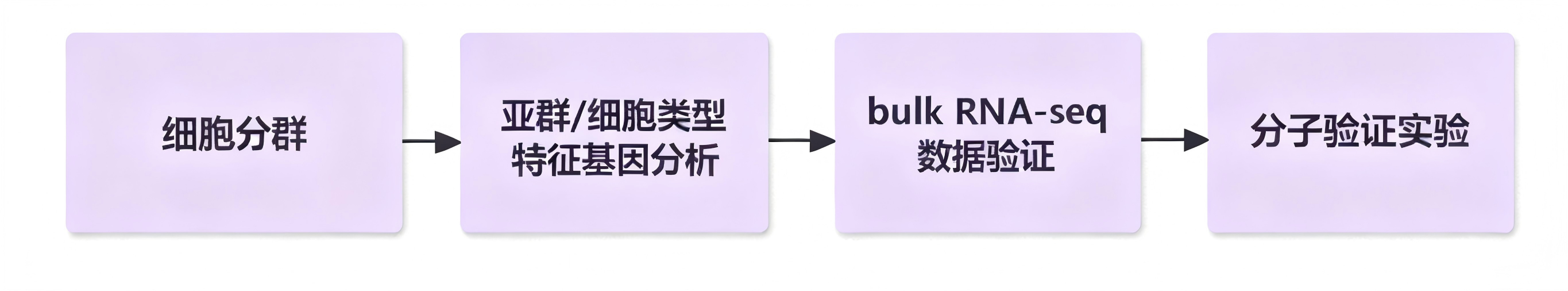
scRNA-seq实验设计:严格设置3个及以上生物学重复,规避个体差异及技术偏差对细胞亚群注释、特异性基因筛选的干扰,精准识别不同细胞类型的特征性表达谱及核心调控基因。
Bulk RNA-seq实验设计:选取与scRNA-seq来源一致的组织样本或细胞群体,保持实验分组、处理条件的一致性,同步设置3个及以上生物学重复,通过群体水平测序验证scRNA-seq所获细胞类型特异性基因的表达趋势,强化结果的统计学意义与普适性。
二、基于Bulk RNA-seq筛选的差异表达基因,通过scRNA-seq精确定位其表达的靶细胞亚群

scRNA-seq实验设计:设置3个及以上生物学重复,确保细胞亚群分群的准确性与稳定性,为差异基因的细胞定位提供高分辨率数据支撑。
Bulk RNA-seq实验设计:可先通过流式细胞术分选目标细胞亚群,或直接采用全组织样本进行测序,筛选不同处理组间的差异表达基因(DEGs);实验需设置3个及以上生物学重复,保障差异基因筛选的可靠性,为后续scRNA-seq精准定位其表达的细胞亚群提供明确靶向。
💯核心分析
💯文献案例
一:ATM缺失诱导小胶质细胞激活促进共济失调毛细血管扩张症的神经退行性病变
标题:ATM-deficiency-induced microglial activation promotes neurodegeneration in ataxia-telangiectasia
期刊:Cell Reports
影响因子:6.9
研究背景:
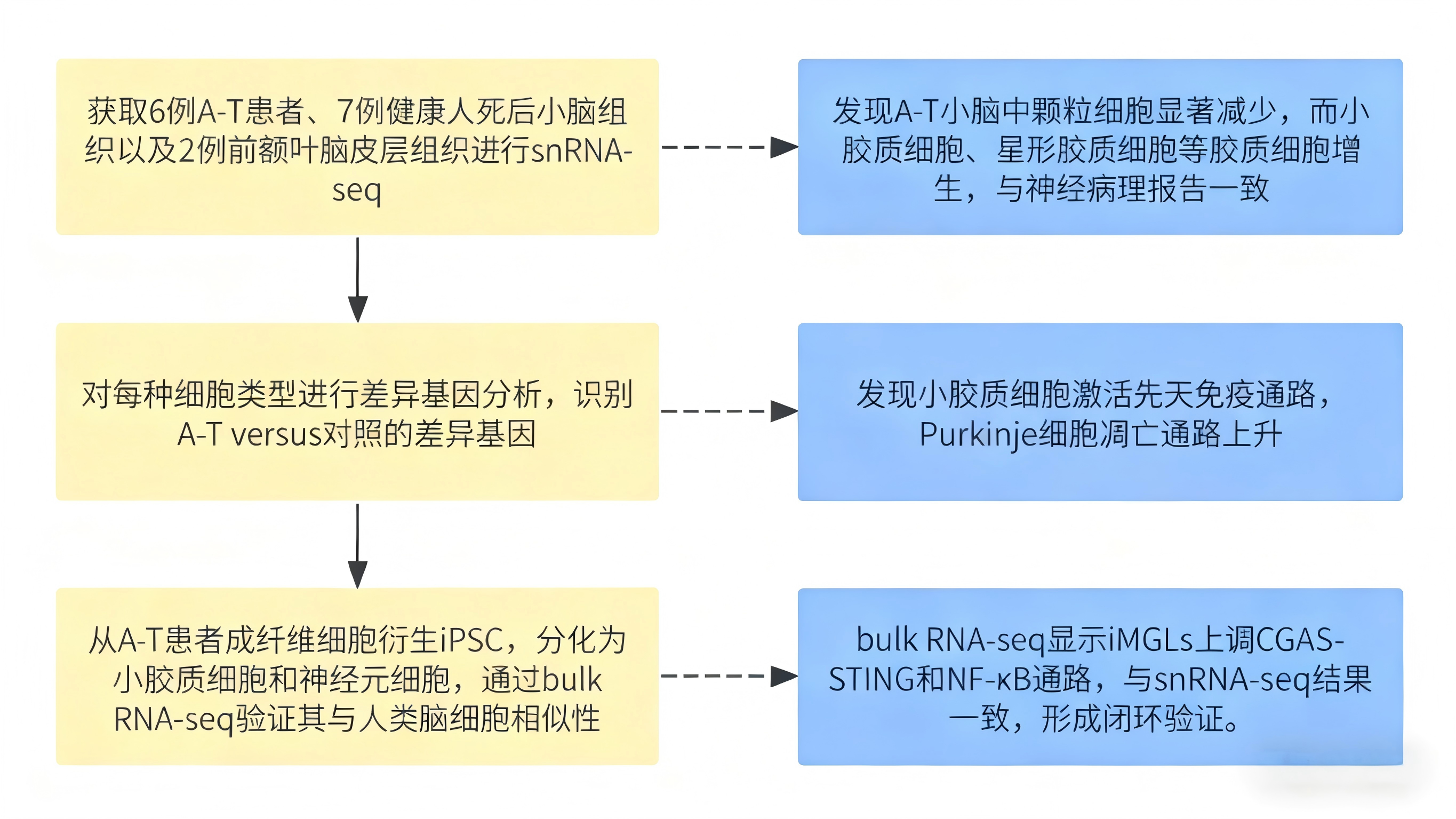
共济失调-毛细血管扩张症(ataxia-telangiectasia, A-T)是一种由ATM基因突变所致的罕见遗传性疾病,其核心病理特征为选择性小脑神经元进行性退化,临床表现复杂且预后较差,目前其潜在发病机制尚未完全阐明。ATM蛋白作为多功能调控分子,除核心介导DNA损伤应答通路外,还广泛参与细胞代谢稳态调控、溶酶体功能维持等多种生理过程。值得注意的是,ATM缺失小鼠模型难以复现人类A-T特有的小脑退化表型,而人类细胞层面的研究提示,钙信号通路(如ITPR1介导的信号传导)紊乱、突触功能异常及氧化应激失衡等可能参与疾病发生。近年来,新兴研究证据表明小胶质细胞吞噬功能障碍或与A-T病理进程密切相关,但其在ATM缺失介导的神经退行性病变中的具体作用机制及调控网络,仍是当前领域亟待明确的关键科学问题,也为该研究的开展提供了核心切入点。
研究思路:
研究结果:
本研究创新性整合单核RNA测序(snRNA-seq)与Bulk转录组分析技术,系统解析了ATM缺陷介导共济失调毛细血管扩张症(A-T)小脑退化的细胞特异性机制。此前基于Bulk转录组的研究虽已揭示A-T患者脑组织整体基因表达谱的紊乱特征,但受限于群体平均表达水平的检测模式,无法精准区分不同细胞类型的特异性转录组变化,难以阐明病变的细胞起源。为此,本研究通过snRNA-seq技术构建了人类小脑及前额叶皮层的高分辨率单细胞转录组图谱,成功注释出浦肯野细胞、颗粒细胞及小胶质细胞等中枢神经系统核心细胞类型。
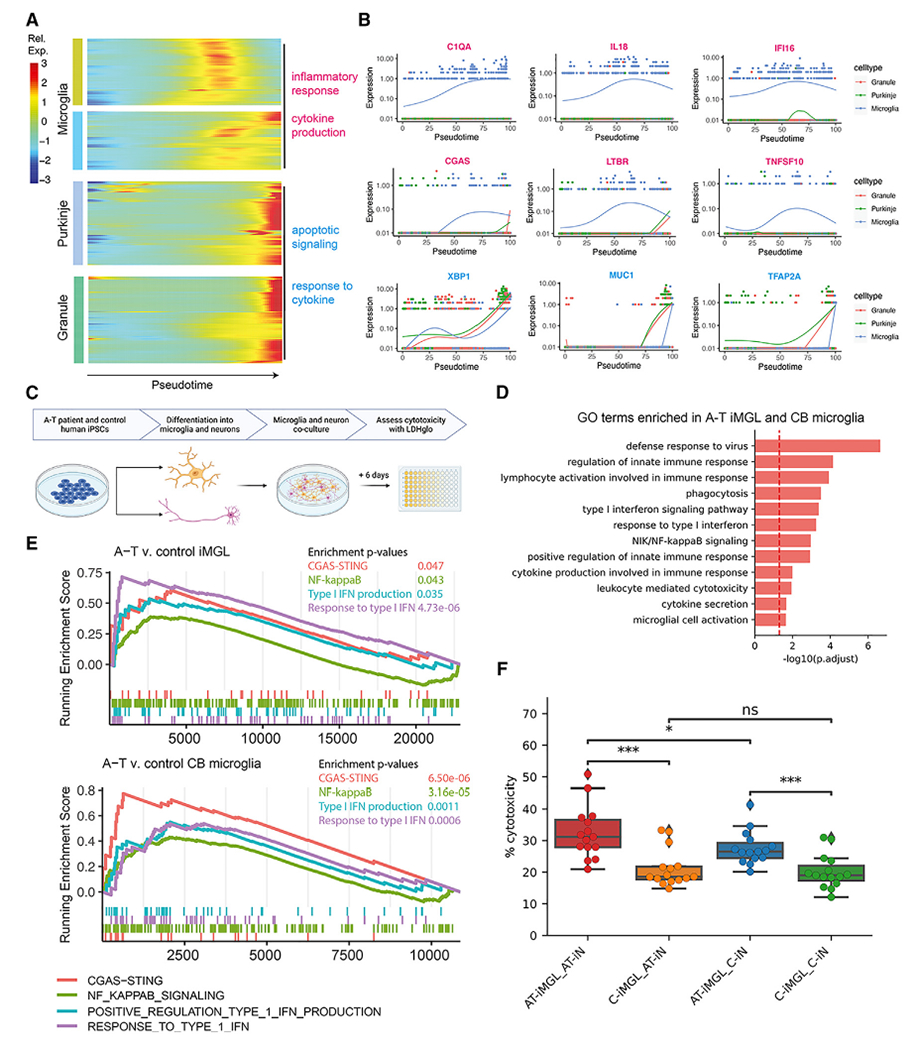 A-T患者iPSC衍生的小胶质细胞在神经元共培养中表现出细胞内激活和细胞毒性增强
A-T患者iPSC衍生的小胶质细胞在神经元共培养中表现出细胞内激活和细胞毒性增强二:E3 泛素连接酶 Rbx1 介导胸腺发育调控及 αβ/γδ T 细胞命运抉择
标题:E3 Ligase Rbx1 Orchestrates Thymus Development and Fate Determination of αβ-γδ T Cells
期刊:Research
标题:E3 Ligase Rbx1 Orchestrates Thymus Development and Fate Determination of αβ-γδ T Cells
期刊:Research
影响因子:16.6
研究背景:
胸腺是 T 细胞分化的核心场所,骨髓来源的前体细胞在此分化为 αβ 与 γδ 两大亚型,DN3 阶段为二者的命运分叉关键节点:αβ T 细胞进一步发育为 CD4⁺/CD8⁺亚群,参与机体适应性免疫应答;γδ T 细胞则作为先天免疫效应细胞,可分化为 IFN-γ⁺(γδ T1)或 IL-17⁺(γδ T17)亚群,在抗感染与抗肿瘤中发挥重要作用。目前,调控 αβ/γδ T 细胞分化的分子机制仍未阐明。Neddylation-CRL 系统是最大的 E3 泛素连接酶家族,其通过 Rbx1/Sag 等 E3 酶及 Ube2m/Ube2f 等 E2 酶介导底物泛素化降解,虽已被证实参与 Treg、树突状细胞等免疫细胞的功能调控,但其在胸腺发育及 αβ/γδ T 细胞命运决定中的作用,至今仍是研究空白。
研究思路:
研究结果:
本研究构建胸腺特异性敲除 Ube2m、Ube2f、Rbx1 或 Sag 的条件性基因敲除小鼠模型,结果证实仅 Rbx1 对胸腺发育及 αβ/γδ T 细胞命运决定具有关键调控作用。Rbx1 缺失可引发胸腺萎缩、T 细胞发育阻滞,伴随胸腺内 γδ T 细胞占比显著升高、未成熟 Gzma⁺ γδ T 细胞比例扩增,且增殖亚群占比降低;上述部分表型可通过共敲除 Bim 实现部分逆转。机制研究表明,Rbx1 缺失会重塑祖 γδ T 细胞 / DN3a 细胞中 Akt、NF-κB 及代谢通路的活性;最终,Rbx1 缺失可显著改变胸腺内 γδ T1/T17 细胞亚群的构成,明确揭示 Rbx1 对 γδ T 细胞命运决定的调控功能。
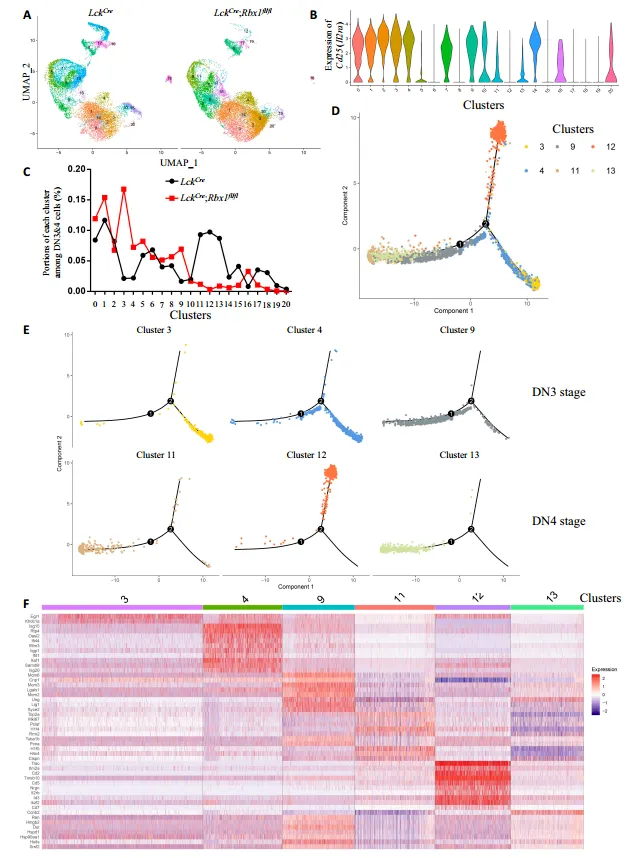
Rbx1对DN3和DN4细胞功能的单细胞转录组测序研究
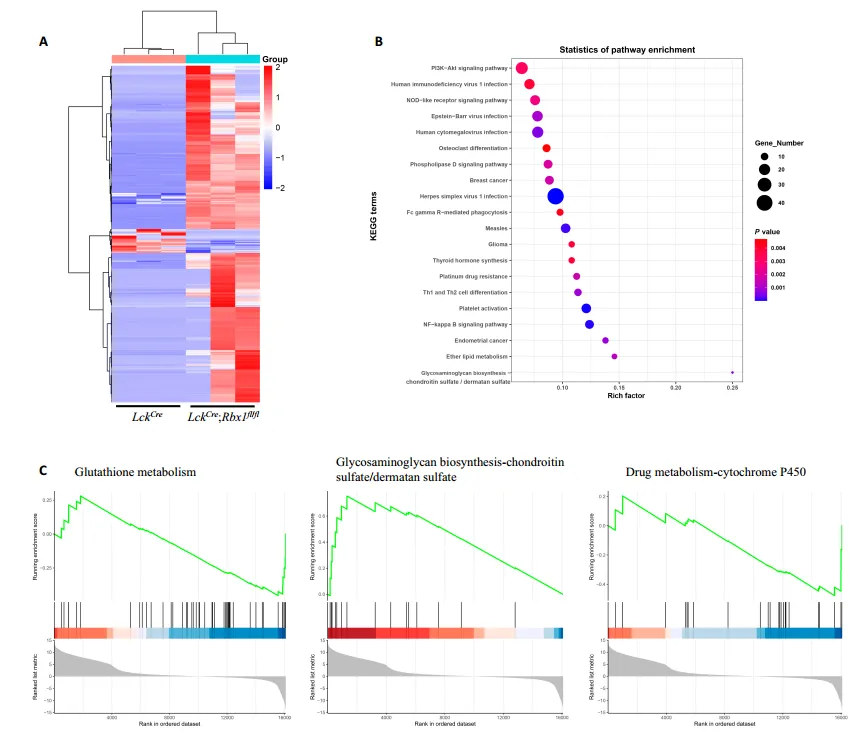
胸腺中Rbx1缺陷型DN3a细胞的转录分析
三:衰老免疫细胞释放颗粒钙素促进骨骼衰老
标题:Senescent immune cells release grancalcin to promote skeletal aging
期刊:Cell Metabolism
期刊:Cell Metabolism
影响因子:30.9
研究背景:
骨髓微环境通过提供信号支持并调控各类骨相关细胞功能,维持骨稳态平衡。骨稳态的维持依赖骨髓内细胞活动的协同调控,其中成骨细胞介导的骨形成是核心环节之一。然而,衰老过程中骨稳态常被打破,表现为骨转换水平降低、骨髓脂肪异常积聚,最终诱发骨质疏松及脆性骨折,其潜在机制尚未完全阐明。已有研究证实,免疫细胞随衰老在骨髓中富集,可能通过分泌特异性因子参与骨衰老进程;颗粒钙素(GCA)作为五 EF 手钙结合蛋白家族成员,虽已知参与免疫调节,但在骨衰老中的具体功能及调控通路仍不明确。基于此,本研究旨在系统探究 GCA 作为衰老免疫细胞分泌因子,通过受体 PLXNB2 介导的信号通路抑制骨形成、促进脂肪生成的分子机制,为揭示骨衰老新机制及开发针对性干预策略提供潜在靶点。
研究思路:
研究结果:
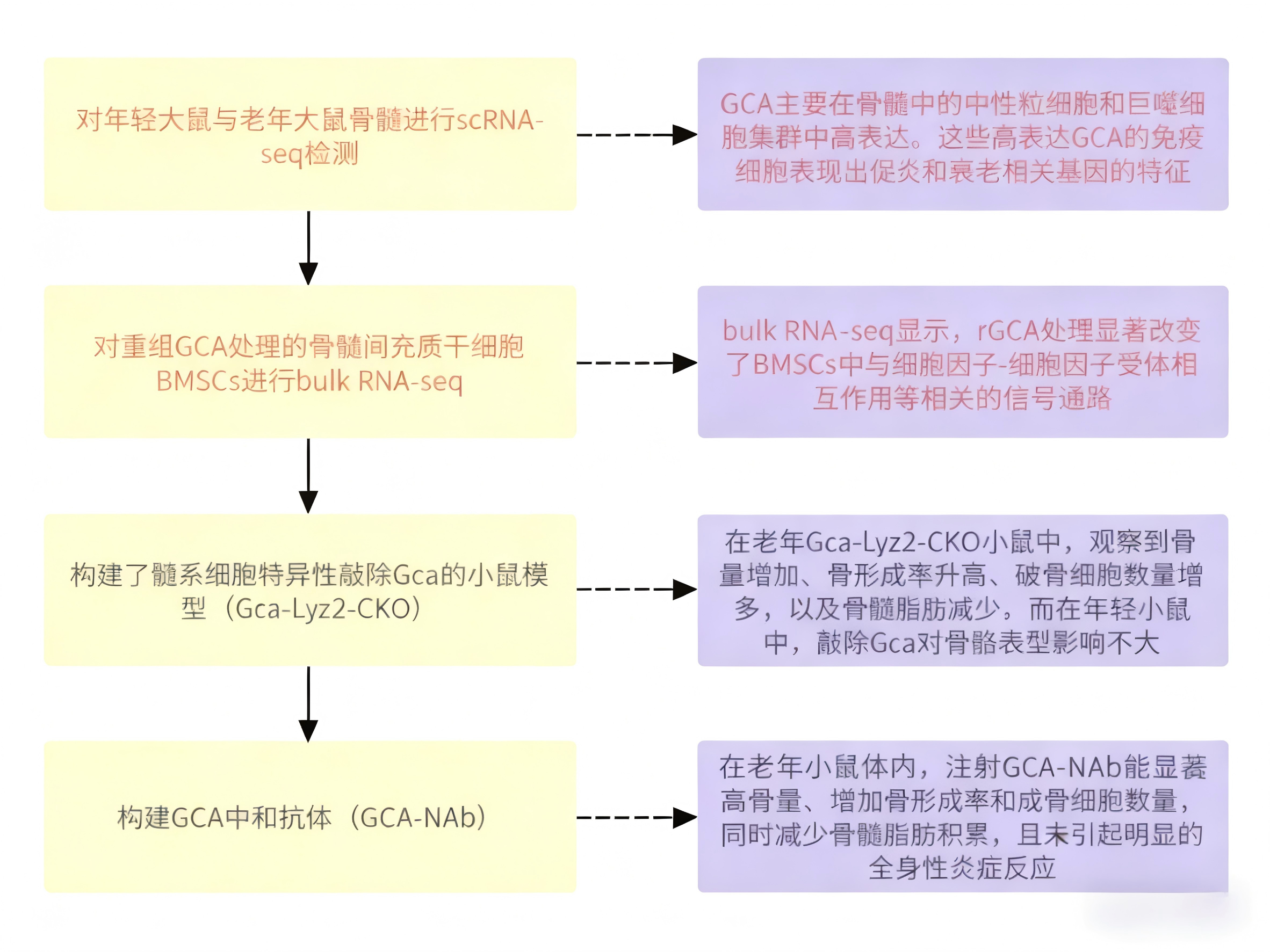
本研究发现,大鼠与小鼠衰老进程中,促炎及衰老表型的免疫细胞亚型(含巨噬细胞、中性粒细胞)在骨髓中富集,并大量分泌颗粒钙素(GCA)。向幼鼠注射重组 GCA(rGCA)可直接诱导骨骼早衰;反之,特异性敲除中性粒细胞与巨噬细胞中的 GCA 基因,能显著延缓骨骼衰老进程。机制层面,GCA 可与 plexin-B2 受体结合,通过部分抑制其下游信号通路,调控骨髓间充质干细胞功能,最终抑制成骨分化、促进脂肪生成。进一步研究显示,骨骼干细胞中 Plexnb2 杂合子缺失,可显著改善 GCA 基因敲除小鼠的骨表型。此外,作者研发的 GCA 中和抗体,对老年小鼠进行治疗后可有效改善其骨骼健康。综上,本研究证实 GCA 是调控骨骼衰老的关键因子,有望成为老年性骨质疏松症的潜在治疗靶点。
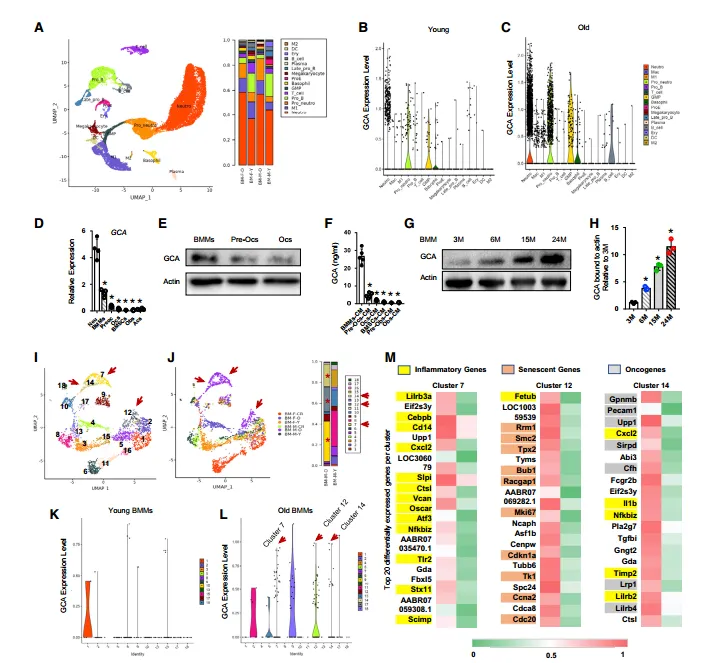
促炎和衰老免疫细胞在骨髓中积累,并在衰老过程中分泌丰富的GCA
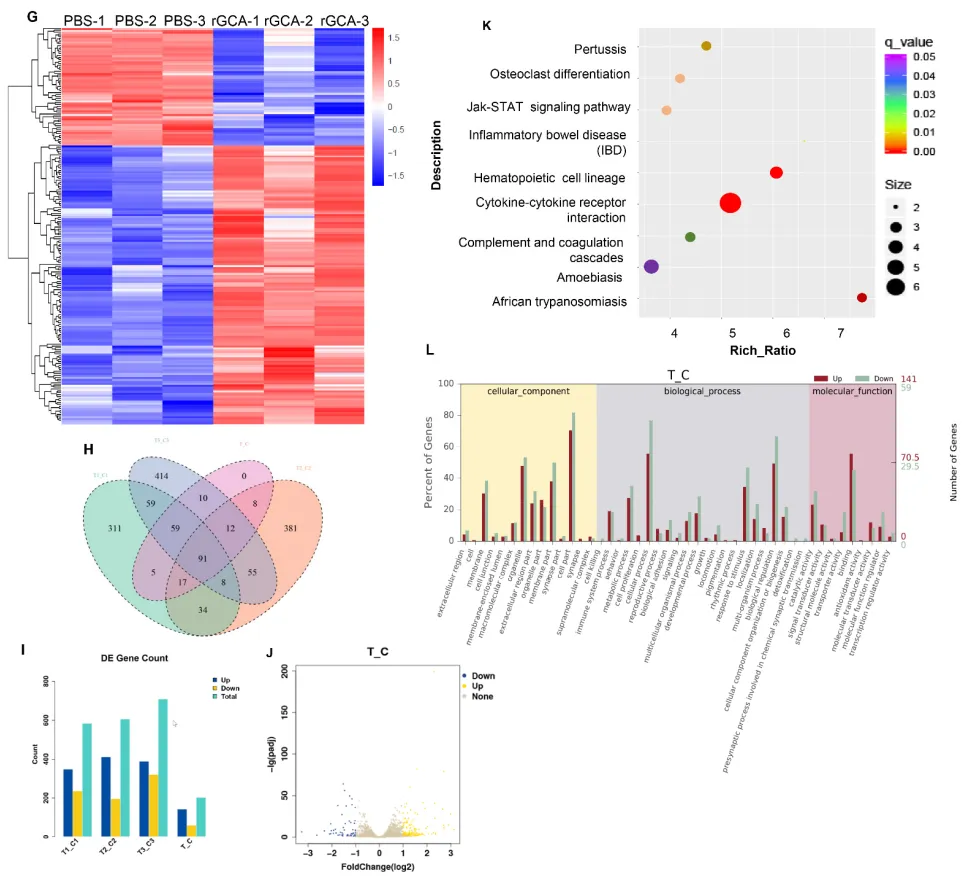
GCA抑制成骨和破骨细胞生成,同时促进脂肪生成
💯总结:
scRNA-seq 与 Bulk RNA-seq 的整合分析,突破了单一测序技术的局限 —— 以 Bulk RNA-seq 构建的宏观表达背景为基础,结合 scRNA-seq 解析的细胞类型特异性及异质性信息,形成 “宏观 - 微观” 相互验证、补充的分析体系,既提升了研究结论的稳健性,又推动生物学机制研究从群体平均表型深入至单细胞异质性层面。目前,该策略已广泛应用于复杂生物学过程解析、疾病发生发展机制探索等领域,成为不可或缺的核心研究工具。展望未来,随着空间转录组、蛋白质组、代谢组等多组学技术的发展,将其与 scRNA-seq/Bulk RNA-seq 整合策略相结合,有望进一步揭示细胞功能的时空动态调控网络,实现对生命活动本质更系统、深入的认知。
💯scRNA-seq 与 Bulk RNA-seq测序哪个公司提供:
乐备实提供单细胞转录组测序(点击)和Bulk RNA-seq测序(点击)。