上海乐备实生物技术有限公司品牌商
6 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
公司新闻/正文
癌细胞转移--一种长期的排兵布阵
489 人阅读发布时间:2021-12-07 11:12
转移是癌症相关死亡的主要原因,包括癌细胞的扩散和二次定植。播散性肿瘤细胞面临许多障碍,只有少数能在远处器官定植。因此,在远处器官定植是转移的限速步骤。远处器官的局部微环境决定了癌细胞是否能够定植。已知原发性肿瘤有助于在次级部位形成有利的微环境,也称为转移前(PM)生态位。肿瘤源性生长因子、炎性细胞因子、趋化因子和外小体对PM生态位的启动和进化至关重要,而免疫细胞,如中性粒细胞、巨噬细胞、髓源性抑制细胞和T细胞,被认为是肿瘤分泌因子的应答者,代表PM生态位的关键成分。例如,中性粒细胞可以分泌白三烯,白三烯可以选择转移起始癌细胞。由活化的中性粒细胞形成的中性粒细胞胞外陷阱(NETs)被证明可以重塑细胞外基质,唤醒休眠的癌细胞并使其转移。
据报道,表达VLA-4的VEGFR1造血骨髓祖细胞与来自常驻成纤维细胞的纤维连接蛋白相互作用,启动PM生态位的形成。肺成纤维细胞和上皮细胞可以摄取肿瘤来源的外体,控制肺的向性。间充质基质细胞(MSCs)存在于几乎所有类型的组织中,对维持组织内稳态和再生至关重要。在肿瘤发展过程中,骨髓和组织中的MSCs可以被动员直接或间接地调节肿瘤细胞。肿瘤间充质干细胞可产生多种生长因子和趋化因子,特别是与免疫细胞和炎症因子相互作用,影响肿瘤的生长和转移。此外,与原发性肿瘤相关的骨髓间充质干细胞通过协调肿瘤免疫微环境,包括单核细胞、巨噬细胞和中性粒细胞的募集,以及增强促瘤免疫反应,促进肿瘤进展。然而,对局部MSC如何参与PM生态位以及它们如何与免疫细胞相互作用形成PM生态位的了解非常有限。
来自苏州大学转化医学研究所辐射医学与防护国家重点实验室的研究团队的一项针对研究证明了常驻骨髓间充质干细胞在乳腺癌细胞肺部PM生态位的形成中起着关键作用。研究发现,骨髓间充质干细胞通过产生补体成分3(C3)将中性粒细胞招募到肺部,并将其转化为网状细胞。骨髓间充质干细胞的促转移作用需要形成网状结构。进一步发现肿瘤发展过程中肺PM生态位中C3的上调是由Th2细胞因子通过STAT6信号通路驱动的。因此,本研究揭示了局部MSC如何对炎性细胞因子作出反应,以及它们如何为癌细胞在肺部的定植准备PM生态位。

以下是文章的整体框架
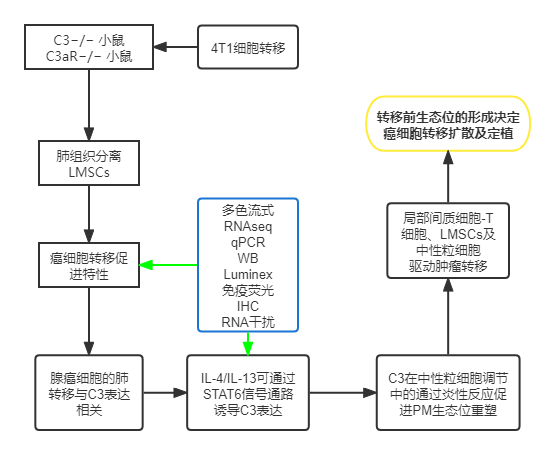
远端PM间充质干细胞具有促进转移的特性
C3在骨髓间充质干细胞的PM生态位高度表达
RNA测序(RNA seq)分析了LMSCs中的基因表达谱(补充图2A)。图2A所示,PM-和M-LMSCs中上调的前20个基因包括补体C3,补体C3是补体系统中的中心蛋白。使用定量PCR确认C3表达的升高。

中性粒细胞向肺的募集依赖于C3a
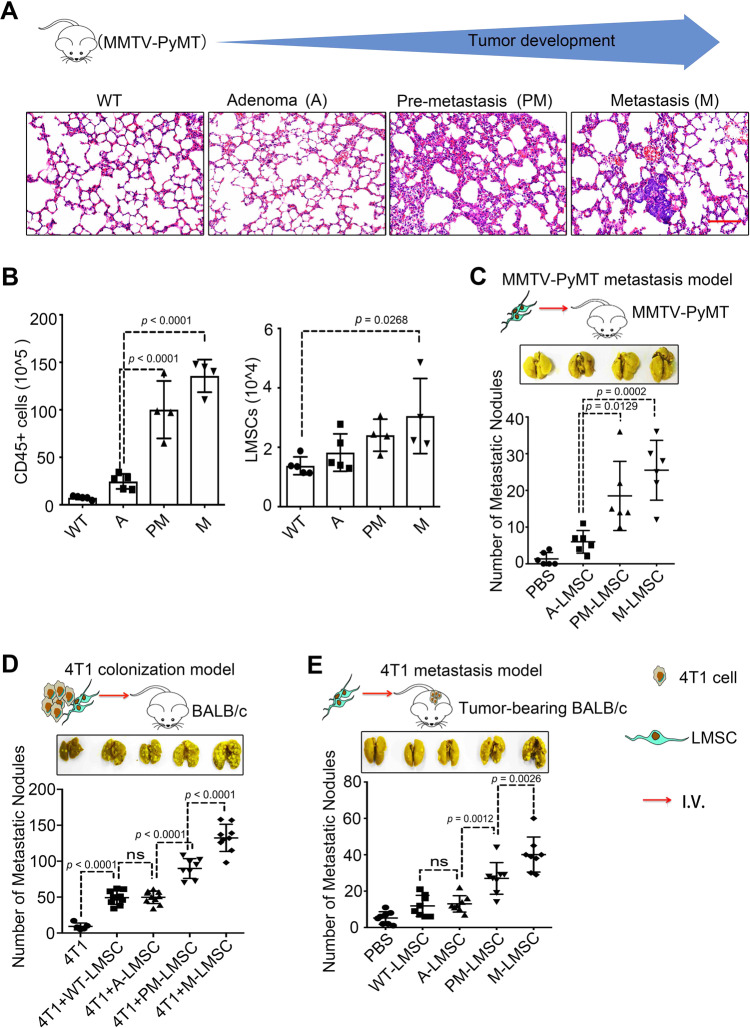
在MMTV-PyMT模型中,肺中中性粒细胞和巨噬细胞的浸润随着肿瘤的进展而增加。
当联合静脉注射4T1细胞时,发现只有中性粒细胞(而非髓系细胞)促进乳腺癌细胞向肺部转移,当C3耗尽时,中性粒细胞募集显著减少。相反,mC3a增加了中性粒细胞的募集。将4T1细胞与LMSCs一起或不一起静脉注射到WT和C3aR中−/− 分别是老鼠。LMSCs不能促进C3aR的肺定植−小鼠。LMSCs不能增加C3aR的肺转移−小鼠。
结果:在体内和体外,LMSCs对中性粒细胞的募集依赖于C3–C3a受体轴。

C3促进net介导的肺转移
通过对肿瘤发展过程中MMTV-PyMT模型中H3 cit的水平检测:
免疫荧光染色和免疫印迹分析显示,PM和M肺中H3 cit水平高于正常和A期肺。来自不同肿瘤阶段小鼠的中性粒细胞和LMSCs的共培养显示,暴露于PM-或M-LMSCs的中性粒细胞显示出更高水平的免疫反应。C3a重组蛋白在体外和体内均提高了H3 cit水平,并上调了中性粒细胞中的网络相关基因。
结果:提示了C3的促转移作用是通过C3–C3a受体轴介导的网状结构的形成。

IL-4/IL-13-STAT6通路诱导C3表达
当先天性和适应性免疫细胞在PM生态位中积累时(补充图1A),它们可以与LMSCs相互作用并重新编程LMSCs的功能。
Luminex检测结果显示:PM和M期,IL-6、IL-13、IL-12和GCSF四种炎症因子显著上调。分别用四种细胞因子中的每一种处理A-LMSCs,发现只有IL-13可以诱导C3表达。PMLMSCs和M-LMSCs中STAT6的磷酸化水平明显高于A-LMSCs。将IL-13和IL-4单独或联合应用于LMSCs。两种细胞因子治疗导致C3的表达水平高于单独使用IL-13治疗。尽管血清中检测不到IL-4,但在PM和M期发现其在肺提取物(PE)中的表达更高,表明IL-4可在肺部局部释放。因此,IL-4/IL-13-STAT6信号可能介导C3上调。免疫荧光分析表明,当用IL-4/IL-13处理时,C3(绿色)和H3 cit(红色)水平仅由WT LMSCs上调,而不是由Stat6LMSCs上调。
结果:提示IL-4/IL-13可通过STAT6信号通路诱导C3表达。

Th2炎症介导强大的促转移特性
通过对MMTV-PyMT小鼠肺中的Th2细胞群进行检测:
检测到随着肿瘤进展,CD4T细胞和Th2细胞的浸润增加,当LMSCs用Th2细胞培养上清液处理时,C3表达显著上调,当与4T1共同注射到BALB/c小鼠中时,经Th2细胞条件培养基处理的LMSCs显示出比未经处理的LMSCs更大的促进转移能力,通过腹腔注射IL-4特异性抗体也可阻断LMSC辅助的定植,
分离CD4T细胞,并分别诱导它们分化为Th1和Th2细胞。当与4T1细胞和LMSCs联合注射时,只有Th2细胞能显著增加转移结节的数量。在用或不用IL-4和IL-13刺激LMSCs下,并将它们与4T1一起注射到裸鼠体内,IL-4/IL-13处理的LMSCs增加了肺转移结节的数量。
结果:提示了IL-4/IL-13来源的Th2细胞,对于维持中性粒细胞向肺部的募集和LMSC辅助的肿瘤转移至关重要。

在乳腺癌患者中,C3的表达水平较高
为了探索可能临床相关性,研究者通过ELISA测定了41名乳腺癌患者(23名局限性乳腺癌患者,18名可检测到转移和7名健康对照者血清中的C3a水平,发现转移组患者的C3a水平在统计学上更高。此外,Kaplan–Meier绘图仪分析研究表明,在乳腺癌样本中,高C1QB(补体C1q亚组分B)和低C1INH(C1 inh,C1酯酶抑制剂)与较差的无远处转移生存率相关。通过免疫荧光测定的巢蛋白阳性细胞。最后,我们还在MBC中检测到H3 cit信号。
结论:这些数据表明C3可能参与了乳腺癌的肺转移。

讨论
1、在转移之前,局部MSC已经被Th2细胞因子如IL-4/IL-13重新编程,其特征是补体C3上调。C3能够招募更多的中性粒细胞到PM部位,并通过C3–C3aR轴促进网状细胞的形成。随着网状结构的增加,更多的循环肿瘤细胞可能被困在肺中并被允许定植,即:LMSCs可以通过招募中性粒细胞和通过C3–C3aR轴促进净形成来重塑PM生态位;
2、在Th2细胞因子(如IL-4/IL-13)的影响下,LMSCs被激活以表达高水平的C3,从而促进中性粒细胞募集、净形成和随后的肺转移。因此,靶向Th2细胞因子–STAT6–C3–NETs轴可能是预防和治疗肺转移的潜在策略。但IL-4/IL-13-STAT6-C3轴可能在其他病理条件下发挥作用(尤其当LMSCs或其他基质细胞参与时)。
详见LabEx网站( http://www.u-labex.com)或来电咨询!
基因水平:PCR Array
蛋白水平:MSD、Luminex、CBA、Antibody Array、ELISA
细胞水平:磁珠分选、流式细胞分析
组织水平:多重免疫组化、病理分析
联系电话:4008-168-068 转3
联系邮箱:labex@univ-bio.com
公众平台:多因子实验服务专家



