上海乐备实生物技术有限公司品牌商
6 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
公司新闻/正文
LabEx多因子检测平台助力类风湿性关节炎研究
351 人阅读发布时间:2024-03-28 16:09
类风湿性关节炎(RA)是一种复杂的自身免疫性疾病,其病理过程涉及单核细胞衍生巨噬细胞(MDMs)在关节滑膜中的浸润和激活。研究表明,G蛋白偶联受体激酶2(GRK2)在调控巨噬细胞功能中扮演着关键角色。删除GRK2可重编程巨噬细胞向抗炎表型转变,减轻RA模型小鼠的关节炎症。机制上,GRK2通过与过氧化物酶体增殖物激活受体γ(PPARγ)相互作用,抑制了促进巨噬细胞迁移和血管生成的fms相关酪氨酸激酶1(Flt-1)。 在RA患者的外周血单个核细胞和滑膜组织中,GRK2表达显著增加,并与疾病活动指数呈正相关。GRK2缺陷不仅能够减轻胶原诱导性关节炎的病情发展,还能通过调节CCR2巨噬细胞浸润和改变PPARγ信号通路来影响疾病的进程。此外,研究还发现GRK2活性抑制剂CP-25可以恢复GRK2-PPARγ的相互作用,抑制Flt-1巨噬细胞的活化,从而减轻RA的症状。 总的来说,这些研究揭示了GRK2在RA中的重要作用,为RA的治疗提供了新的靶点。通过抑制GRK2的活性,可以抑制巨噬细胞的活化,减轻RA的症状。这些发现为理解类风湿性关节炎等疾病的分子机制提供了新的见解,并可能为未来的治疗策略提供潜在的靶点。
主要结果
GRK2与RA的滑膜MDM密切相关
在类风湿关节炎(RA)患者中,CD14+CCR2+外周血单核细胞(PBMCs)中的G蛋白偶联受体激酶2(GRK2)表达明显增加,与RA相关的临床表现也呈显著相关。与骨关节炎(OA)滑膜相比,RA滑膜中的GRK2表达显著升高,提示其可能与滑膜炎症密切相关。此外,研究发现RA滑膜中的GRK2与浸润的巨噬细胞激活有关,抑制GRK2活性可降低炎症因子的表达。
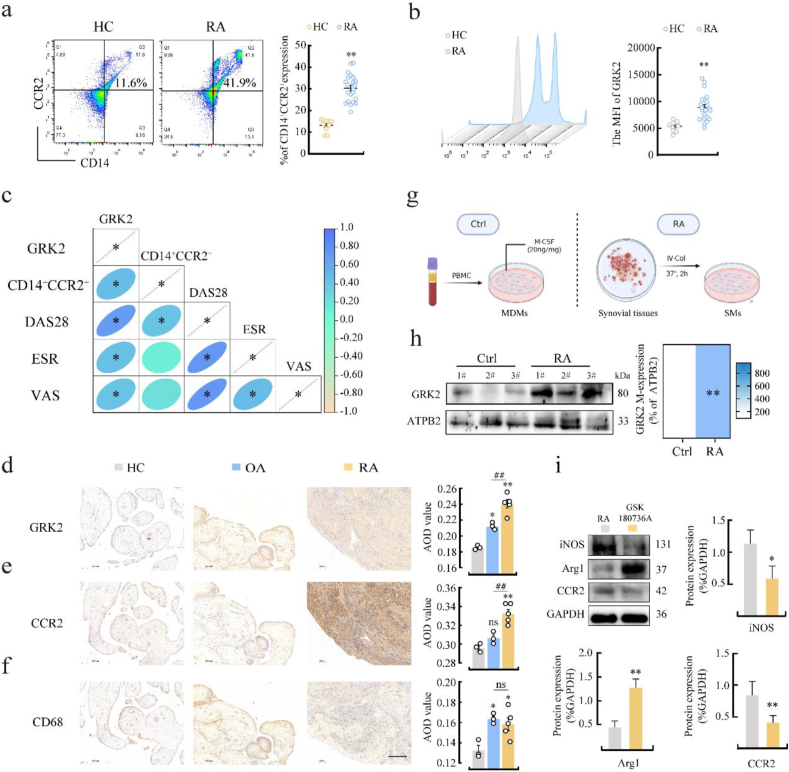
Figure 1 GRK2表达的增加与RA中浸润的滑膜MDMs的激活有关
GRK2缺乏可减轻CIA的发展
该研究针对类风湿关节炎(RA)中巨噬细胞的G蛋白偶联受体激酶2(GRK2)的特异性细胞内信号进行了测试。研究中使用了具有骨髓细胞特异性GRK2缺陷的小鼠,对其进行了共同关节炎(CIA)模型实验。结果显示,GRK2缺陷小鼠的关节炎症状明显减轻,并且在组织学和细胞因子水平上都表现出了更低的炎症反应。进一步的细胞分析显示,GRK2缺陷降低了CCR2+巨噬细胞的浸润和极化程度,但增加了细胞的迁移能力。这些结果表明,GRK2缺陷通过调节CCR2+巨噬细胞的浸润和功能,从而减轻了CIA的发展,但具体机制仍需进一步探索。

Figure 2 GRK2缺乏可减轻CIA的发展
GRK2缺乏会改变MDM中的过氧化物酶体增殖激活受体γ (PPARγ) 信号传导
在两组BMDMs中发现了177个基因的差异表达,其中100个上调,77个下调。基因本体(GO)分析显示,这些基因主要富集在白细胞分化和迁移方面。引人注目的是,PPAR信号通路同时出现在上调和下调基因组中的前五位(PPAR是核激素受体相关的转录因子,有PPARα、PPARβ和PPARγ三种高度保守的亚型)。进一步的实验发现,PPARγ蛋白表达和核蛋白表达下降,而mRNA表达不变。PPARγ已被证明能抑制巨噬细胞的活化和极化,PPARγ激动剂pioglitazone显著改善了关节炎指数。免疫组化显示,RA滑膜中PPARγ的表达减少。但是,PPARγ在RA滑膜中对MDM迁移的作用尚未得到研究。进一步的实验表明,PPARγ激动剂balaglitazone抑制了BMDM的迁移能力和CD11b+CCR2+巨噬细胞的比例。这些发现暗示了GRK2可能通过影响PPARγ的蛋白稳定性或活性来调节其信号通路。
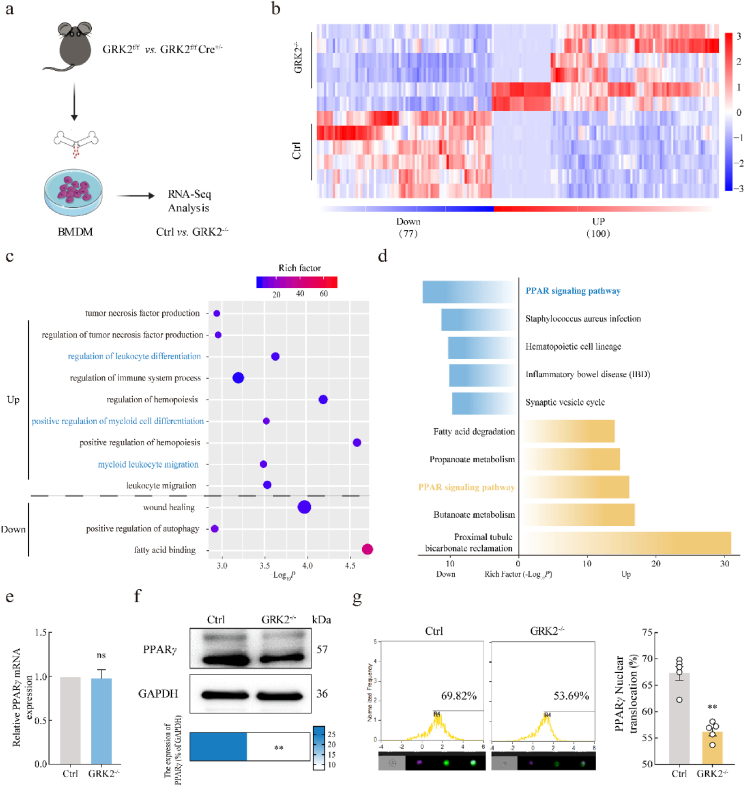
Figure 3 GRK2缺乏会改变BMDMs中的PPARγ信号传导
GRK2靶向PPARγ Tyr473有助于 PPARγ激活
关于GRK2与PPARγ相互作用及其调控机制的研究摘要。GRK2在细胞内与PPARγ直接相互作用,促进PPARγ的活性。这种相互作用是通过GRK2靶向PPARγ的LBD,并主要集中在PPARγ的Tyr473位点。GRK2通过抑制PPARγ的泛素化和降解,维护了PPARγ的稳定性,进而调节了细胞内的信号转导和基因表达。这些发现为了解GRK2在炎症和代谢调节中的作用机制提供了新的视角。
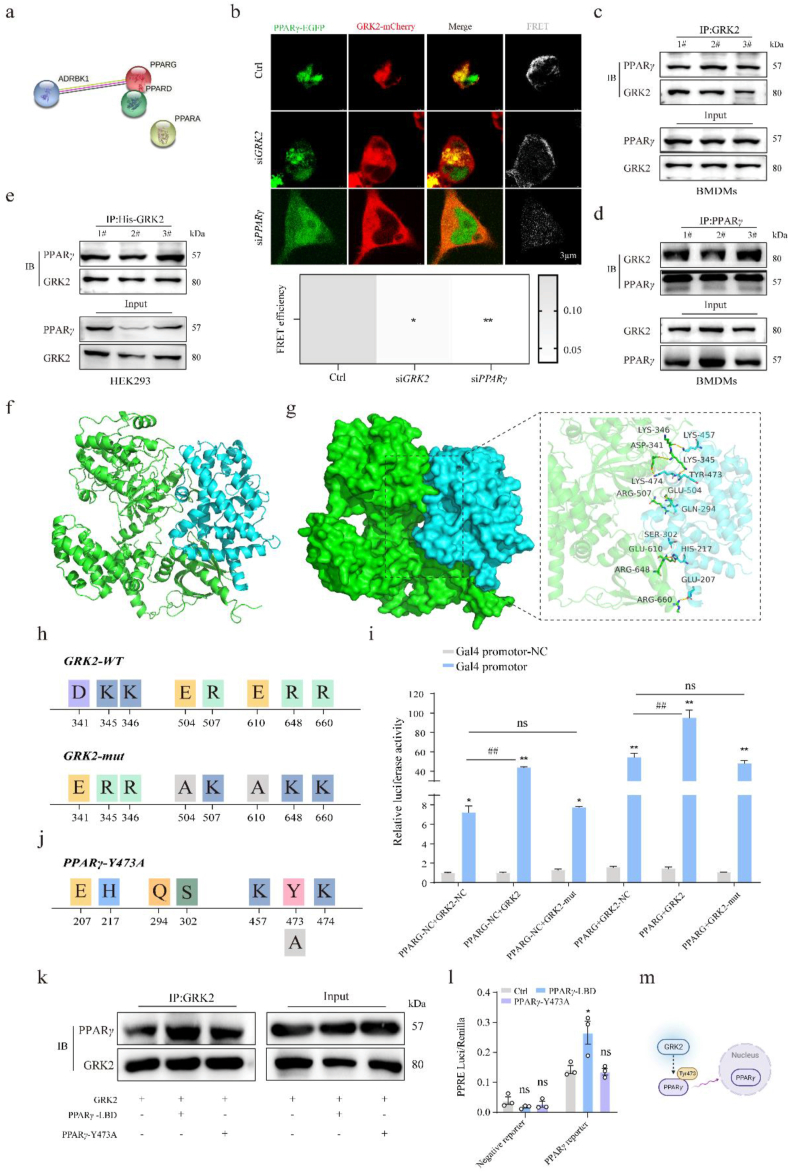
Figure 4 GRK2通过靶向Tyr473激活 PPARγ
GRK2-PPARγ缺乏会促进酪氨酸瘤相关激酶1(Flt-1)的转录
激活的PPARγ可以迁移至细胞核,激活特定基因的转录。为了找到由GRK2激活的PPARγ转录调节的基因,我们首先对野生型和PPARG敲除小鼠获得的BMDMs进行了RNA测序分析。与GRK2f/f小鼠相比,PPARG敲除小鼠的BMDMs中有不同表达的基因(共3778个,其中1934个上调,1844个下调)。对GRK2−/−和PPARG−/− BMDMs以及RA SMs之间的共同DEGs进行Venn图分析,筛选出17个共同DEGs。进一步对这17个基因进行KEGG通路富集分析,发现了FLT1基因。FLT1也出现在GRK2−/− BMDMs的上调和下调DEGs富集的前10个转录因子中。FLT1在人类单核细胞/巨噬细胞系的新型细胞表面标记物中已被证实。在RA中,FLT1的酪氨酸激酶结构域的缺失通过调节骨髓造血细胞的增殖和MDMs的免疫活性来降低RA的发病率和临床症状。这项研究证实了GRK2−/−和PPARG−/− BMDMs中FLT1 mRNA表达显著增加,进一步研究了PPARγ如何转录调节FLT1的表达。
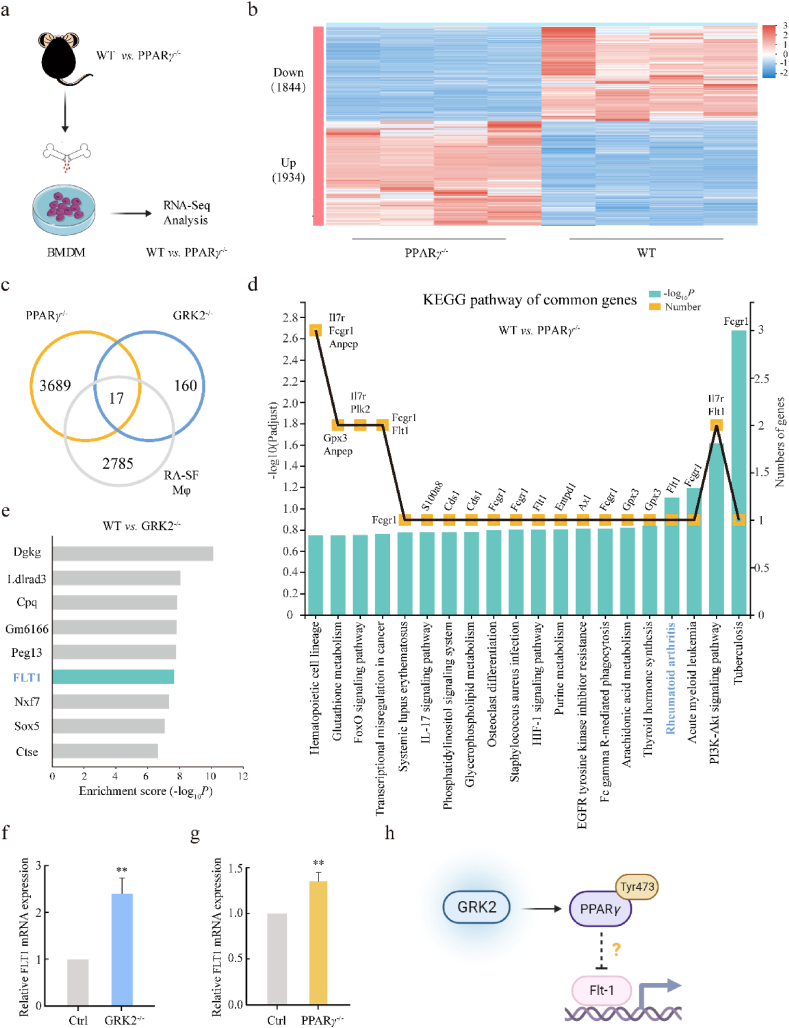
Figure 5 GRK2-PPARγ抑制了 Flt-1的转录
Flt-1促进MDMs迁移,推动血管生成
GRK2如何调节PPARγ以及其在Flt-1+巨噬细胞活化中的作用。GRK2通过与PPARγ相互作用并促进其活性,抑制了Flt-1的转录。在RA中,GRK2过度膜定位导致PPARγ信号降低,Flt-1转录增加。进一步的研究表明,Flt-1+巨噬细胞在RA滑膜中具有增加的迁移能力,而Flt-1的过度表达可能参与了RA的血管生成和炎症过程。这些发现为理解GRK2在RA发病机制中的作用提供了新的认识,并为未来治疗RA的药物设计提供了潜在的靶点。
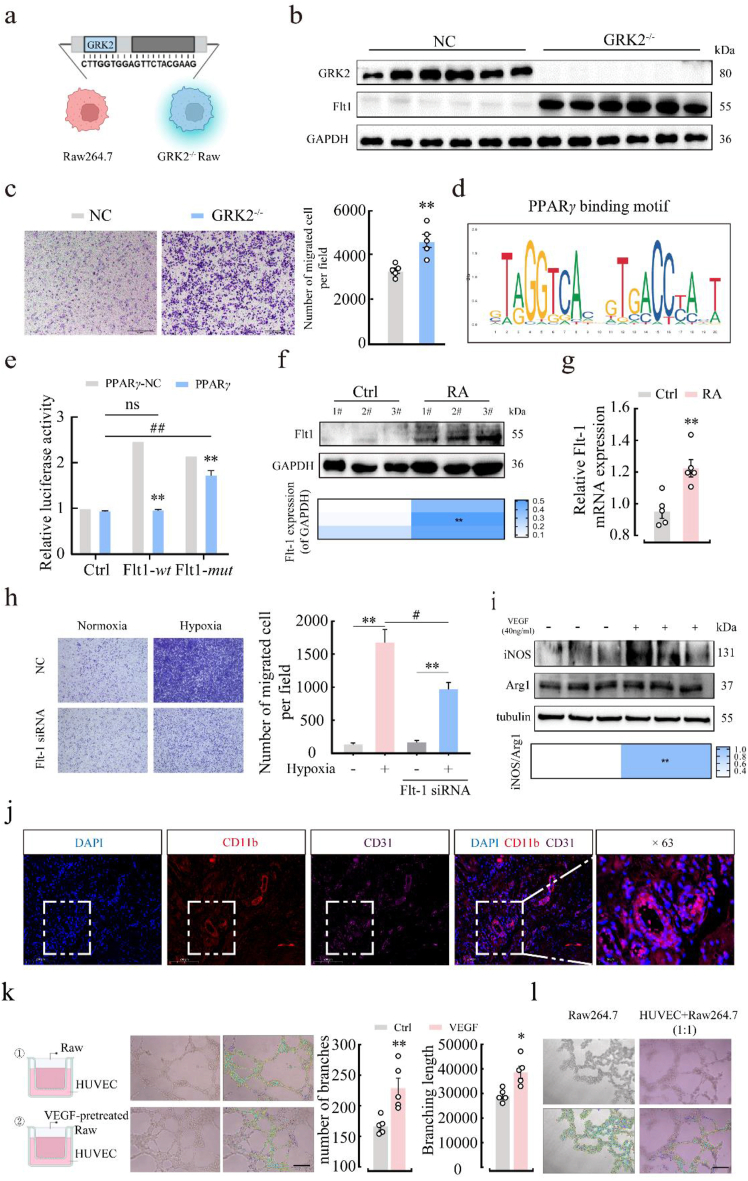
图 6 PPARγ抑制Flt-1的转录并导致血管生成
CP-25恢复GRK2-PPARγ相互作用,抑制CIA中Flt-1+巨噬细胞的活化
CP-25如何通过抑制GRK2活性来调节关节炎模型中的炎症和血管生成。在小鼠关节炎模型中,CP-25显著减轻了炎症、骨侵蚀和破坏,并抑制了炎性巨噬细胞的浸润和血管生成。在细胞水平上,CP-25恢复了GRK2与PPARγ的相互作用,减少了Flt-1的表达,从而抑制了炎性巨噬细胞的活化和血管生成的进程。这些结果表明,CP-25可能作为一种潜在的治疗药物,通过调节GRK2活性来治疗类风湿关节炎,并提供了新的治疗策略的理论基础。
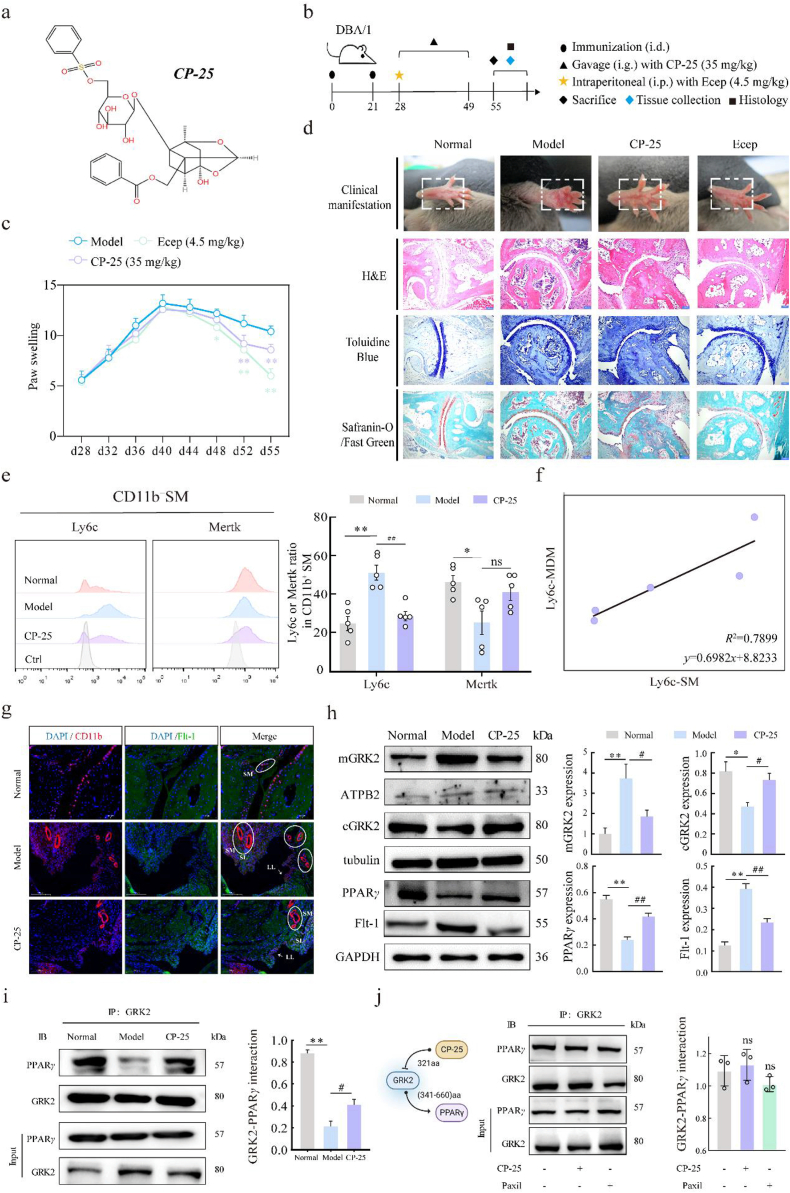
Figure 7 GRK2活性抑制剂对RA巨噬细胞的作用及机制


