上海乐备实生物技术有限公司品牌商
6 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
公司新闻/正文
LabEx,更全面的多因子技术平台,助您揭开肿瘤免疫的面纱!
913 人阅读发布时间:2021-12-07 11:40
免疫系统是癌细胞与肿瘤微环境相互作用中不可或缺的调节器。在与肿瘤微环境相关的免疫效应细胞中,巨噬细胞已被广泛认为参与肿瘤相关炎症、免疫逃逸、基质重塑和癌症转移。据报道,巨噬细胞占恶性实体瘤的5~40%。巨噬细胞在局部微环境刺激下表现出相当大的功能可塑性。在体外,活化的巨噬细胞在功能上分为两类,M1和M2。肿瘤相关巨噬细胞(TAM)被称为癌细胞招募和培养的巨噬细胞群体,在肿瘤微环境中发挥重要作用。

第一步
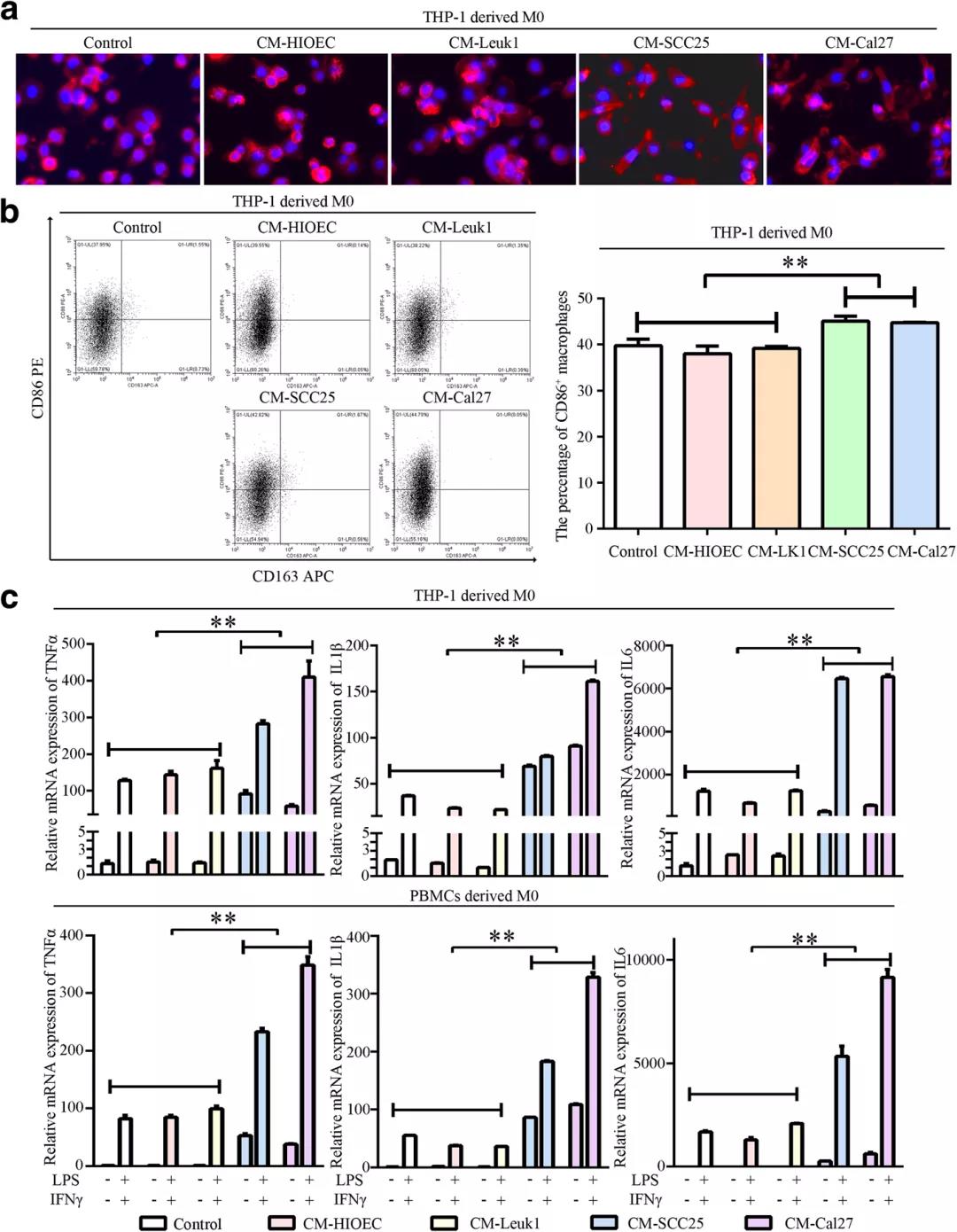
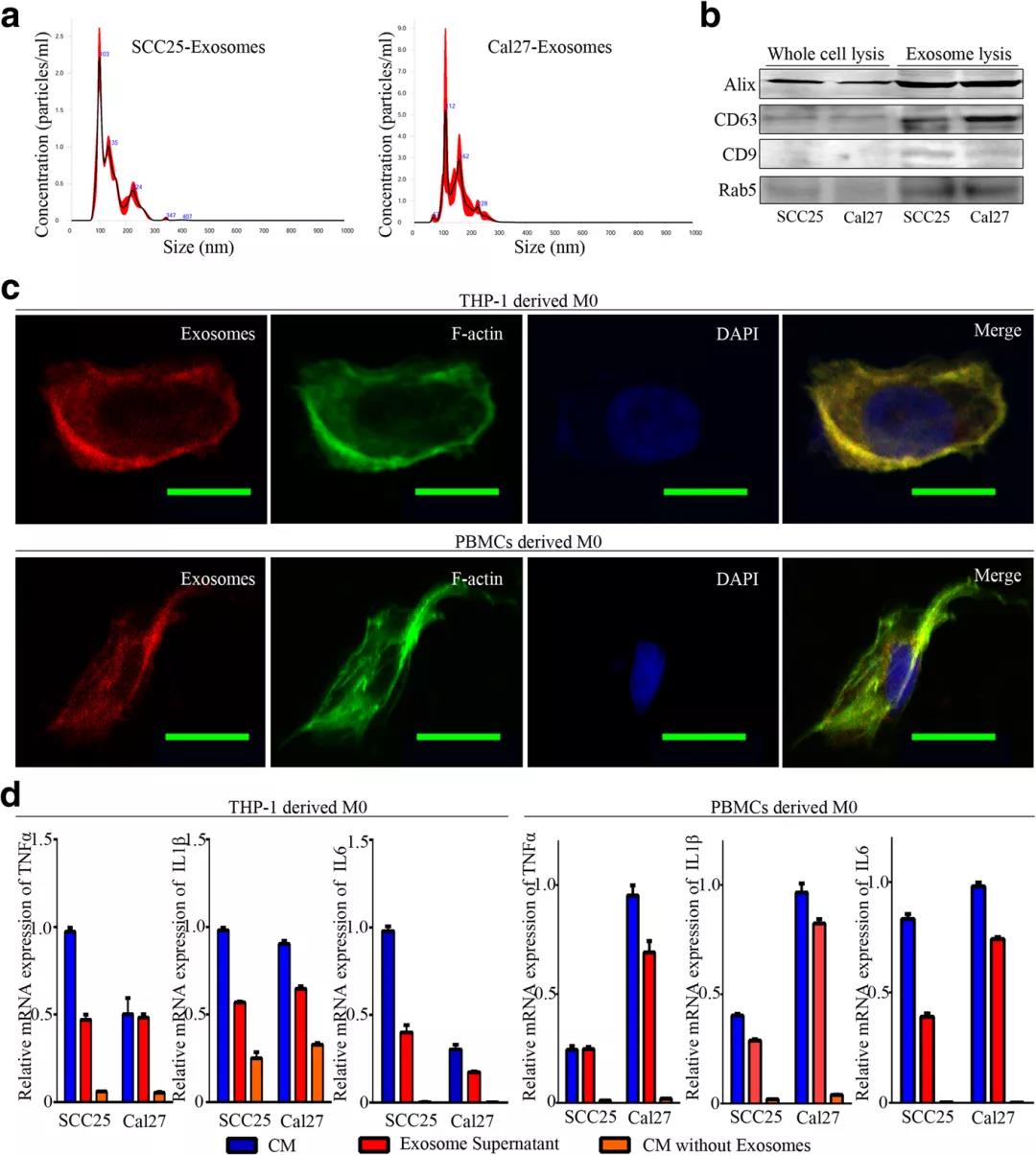
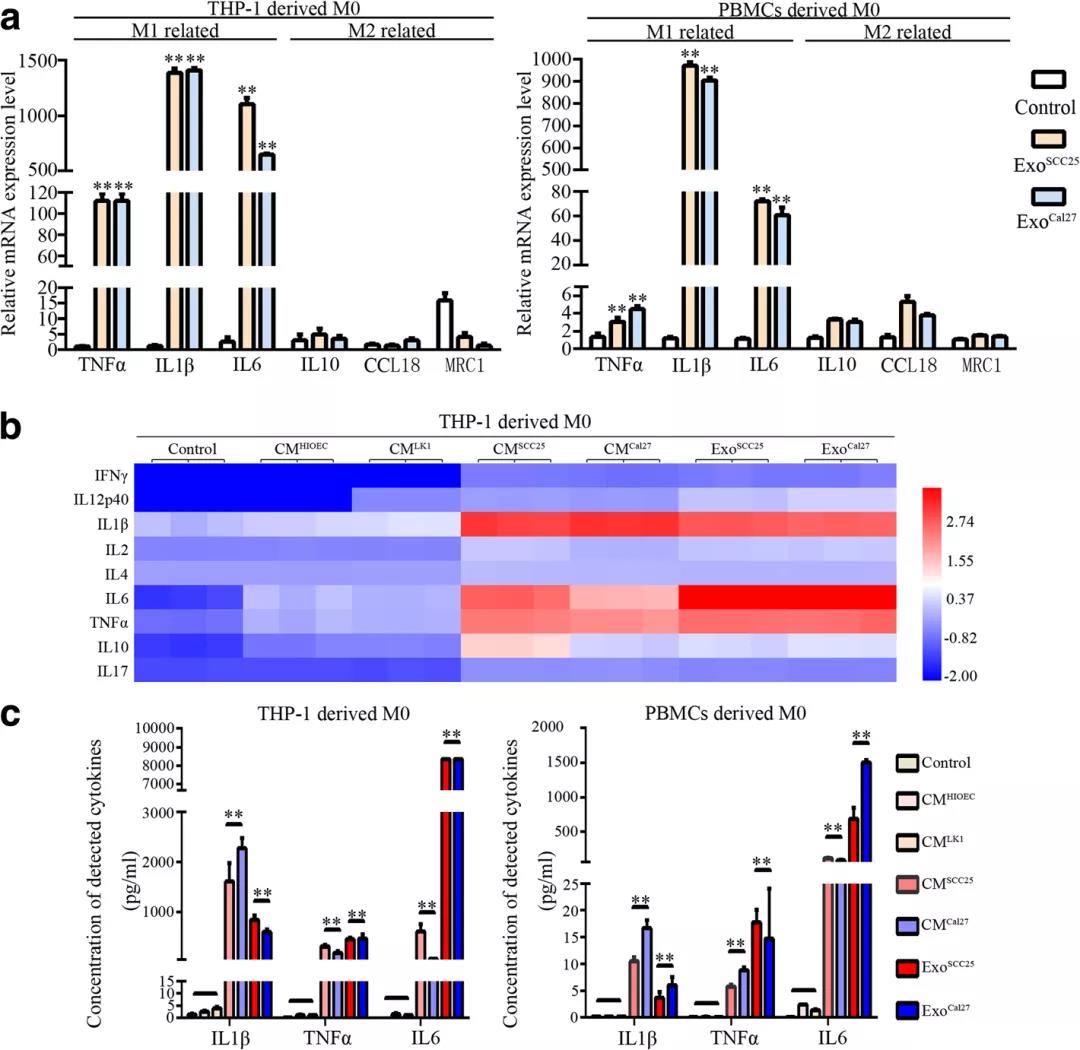
结果提示:OSCC衍生的CM和外体上清液显著提高了这些M1相关细胞因子的分泌水平,表明OSCC-CM中的外显体激活巨噬细胞进入M1样表型。
结果提示:在20例OSCC样本中,CD68+CD80+区域占所有CD68+区域的31%(范围:22-45%)。表明,在OSCC组织中广泛存在M1样巨噬细胞。
第三步
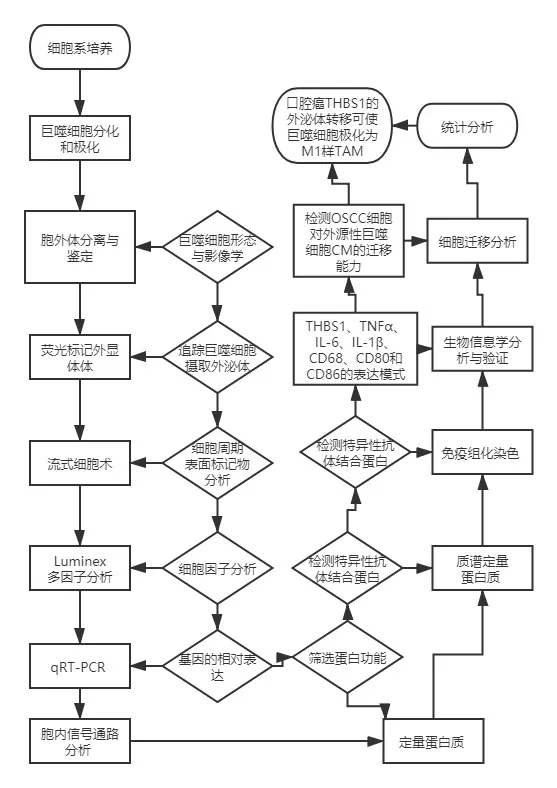
荧光标记细胞观察和拍摄处理过的巨噬细胞的形态,荧光标记外泌体并追踪巨噬细胞摄取外泌体。染色后,通过流式细胞术分析细胞。使用Luminex进行细胞因子分析,计算以下基因的相对表达:TNFα、IL1β、IL6、IL10、CCL18、MRC1、CD80、HLA-DRα、PAI1和THBS1。
结果提示:外显体处理的THP-1衍生巨噬细胞中细胞内MAPK,尤其是p38 MAPK的显著激活,TNFα、IL1β和IL6 mRNA表达水平的动力学分析表明,巨噬细胞的激活发生在刺激外体后的早期阶段,并观察到p38 MAPK、Akt和SAPK/JNK的激活。免疫印迹分析进一步证实p38 MAPK、Akt和SAPK/JNK信号的激活发生在外体刺激后的早期。
第四步
细胞内信号通路分析细胞裂解产物,质谱(MS)无标记定量蛋白质;蛋白免疫印迹检测特异性抗体结合蛋白条带,免疫组化染色测量CD68+CD80+区域在CD68+区域中的比例。
结果提示:通过聚焦炎症相关通路(PI3K-Akt、HIF-1、MAPK、Notch、NF-κB和Ras信号通路)筛选共享的蛋白质。发现891个蛋白质在SCC25和Cal27衍生的外显体中重叠,最终,39个蛋白质保留下来,并通过UniProtKB数据库进行进一步的功能分析。GO生物分析发现,THBS1在39种选定蛋白质中的覆盖率最高,对巨噬细胞活化具有正调控作用;
当敲除OSCC细胞中THBS1的表达时,受指示CM和外体上清液刺激的THP-1衍生巨噬细胞的TNFα、IL1β和IL6的表达水平显著降低;
收集外小体激活的巨噬细胞的CMs,并将其处理至OSCC细胞。在治疗期间,未观察到SCC25和Cal27的增殖能力有显著反应。然而,CMs显著促进OSCC细胞的运动。这些数据表明,暴露于外显体的巨噬细胞来源的因子在OSCC的恶性迁移中起着重要作用。
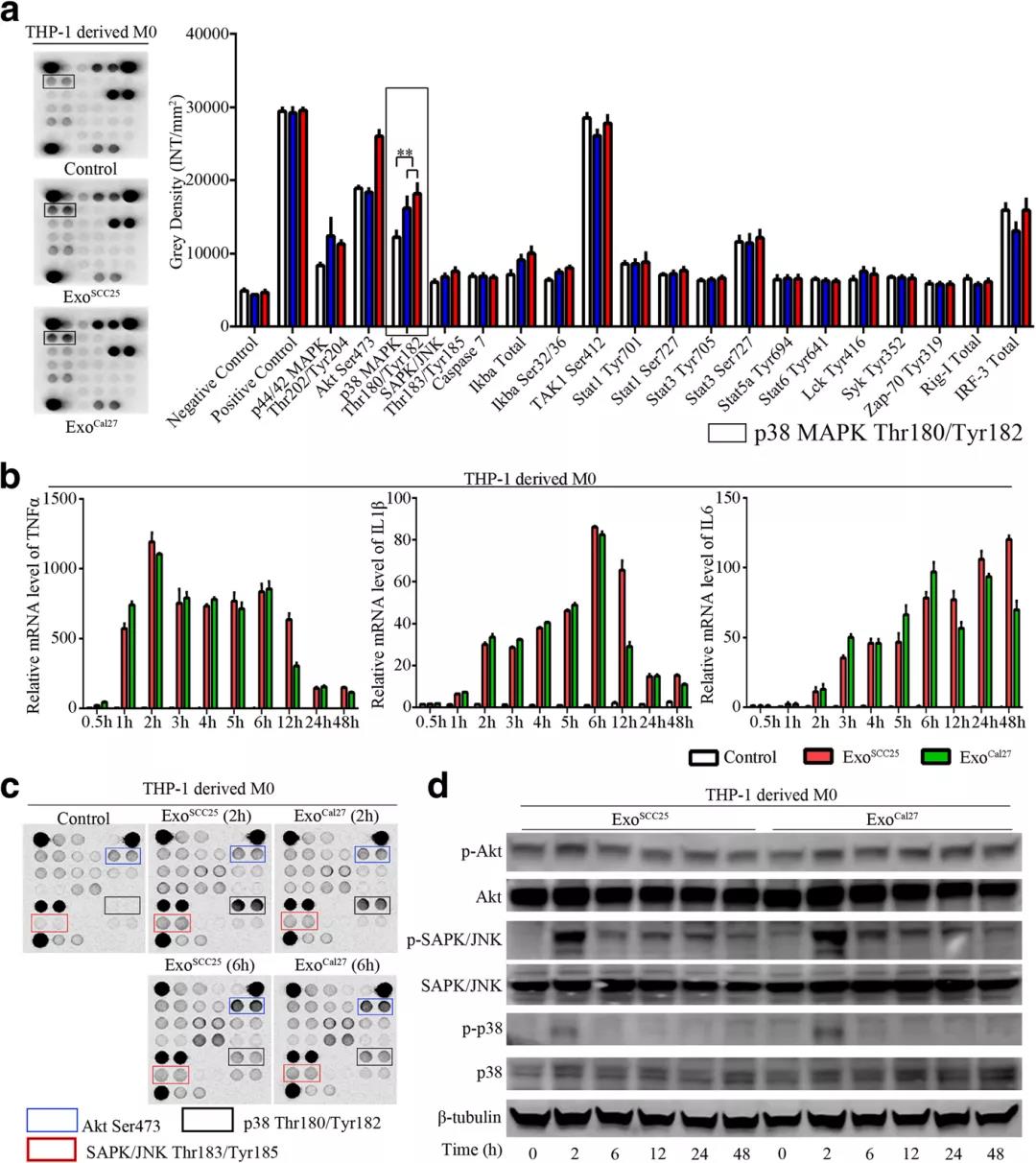
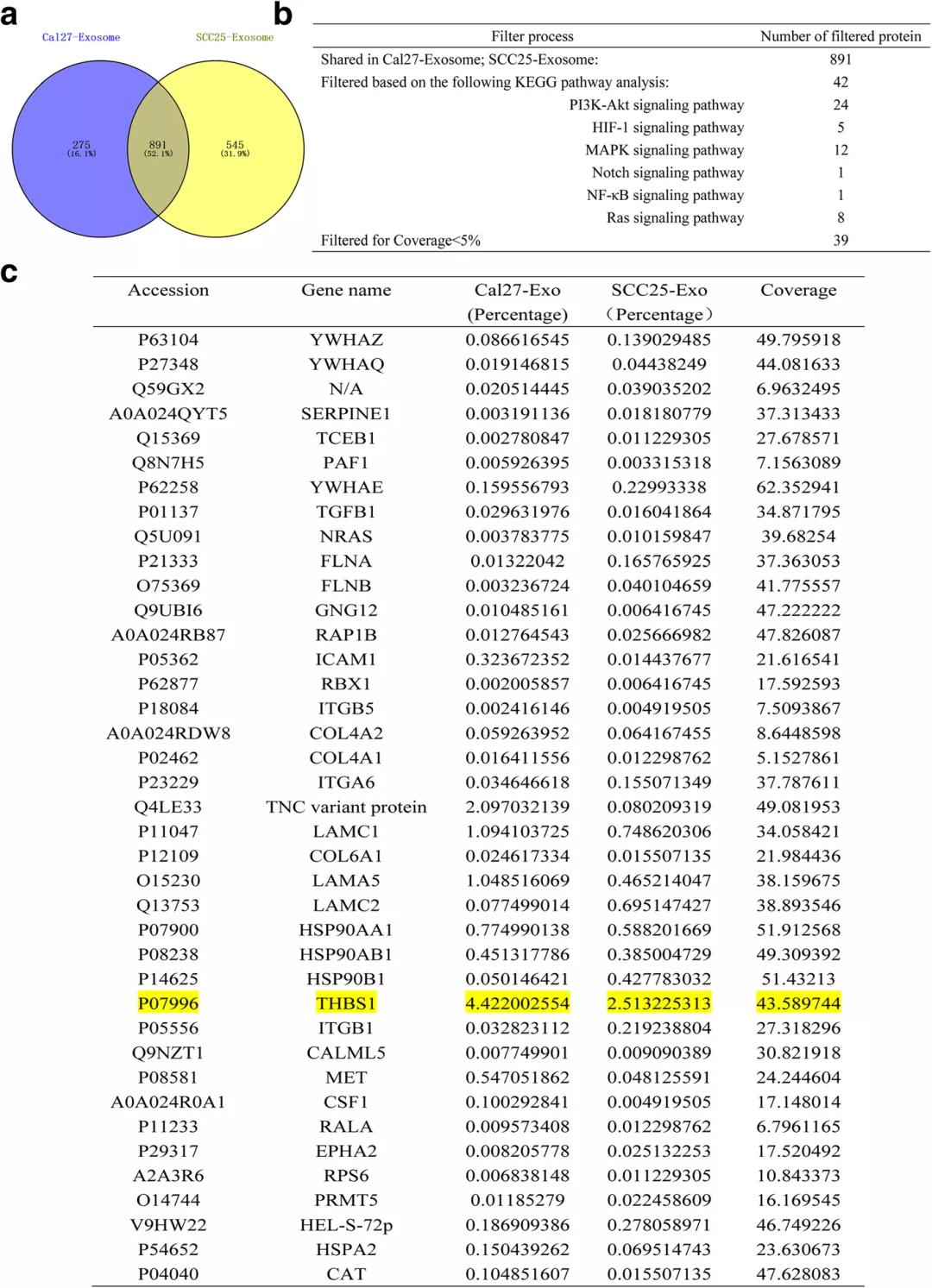
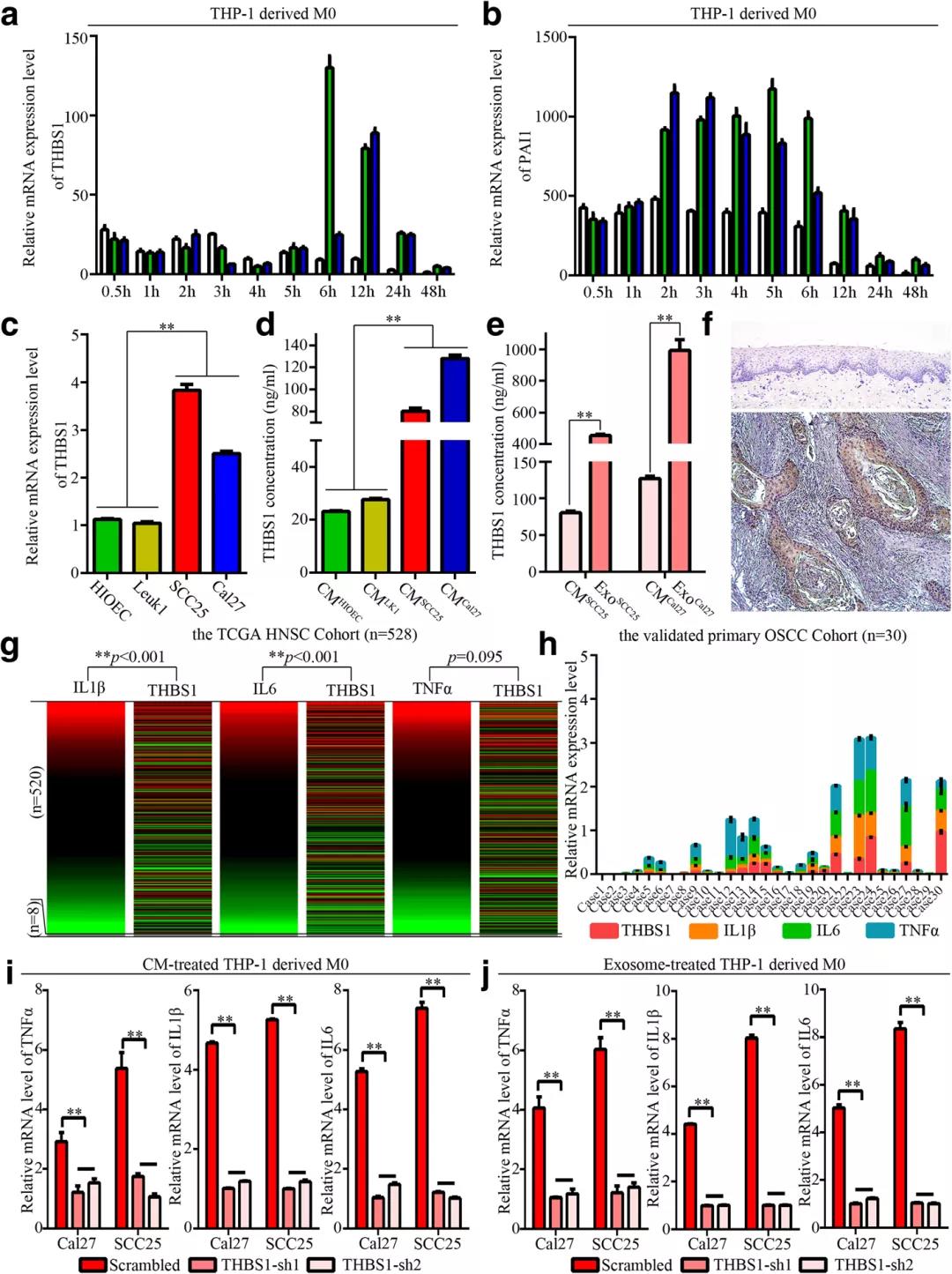
第五步
生物信息学分析与验证
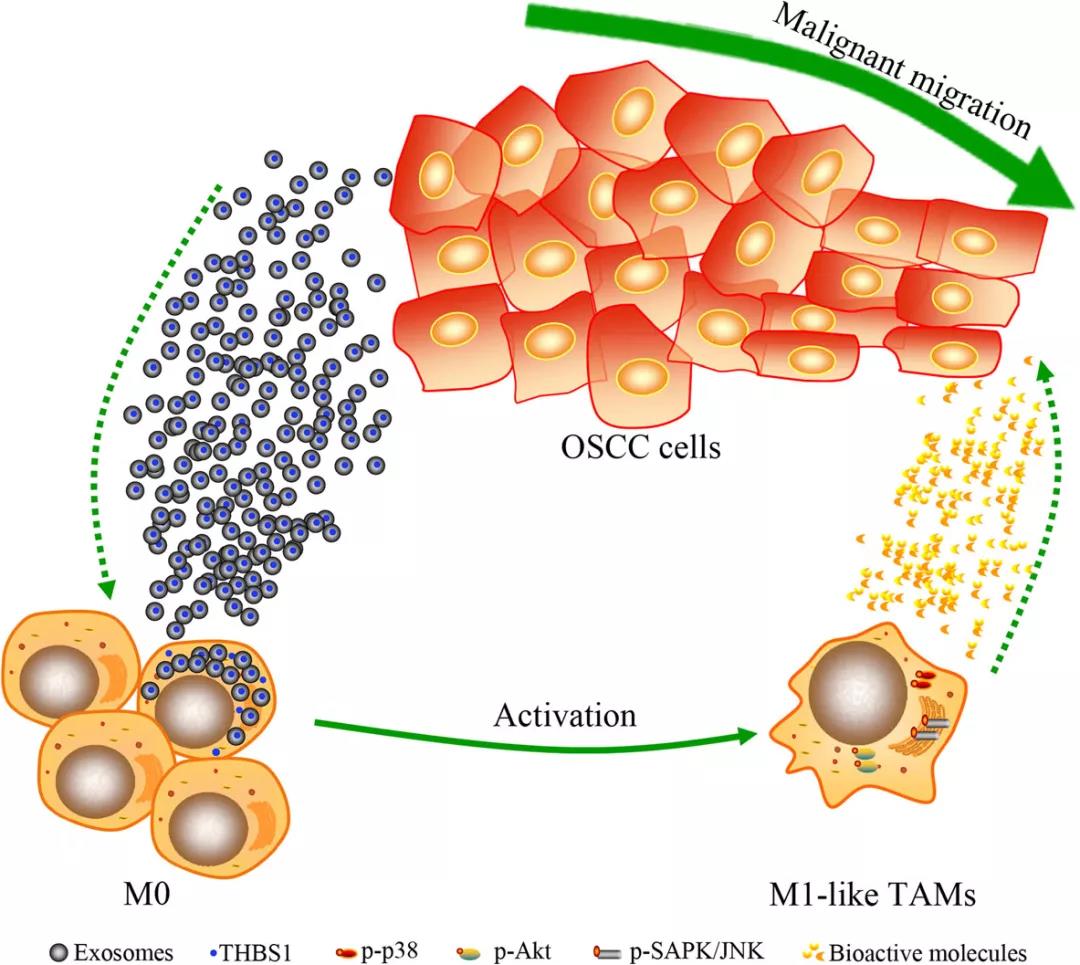
结果提示:巨噬细胞的浸润和极化被认为是癌变过程中的一个基本事件,TAM和癌细胞之间存在旁分泌环。然而,很少有研究报道TAM在上皮癌发展过程中的行为。本研究采用具有代表性的OSCC发展模型来说明巨噬细胞的可塑性。在这里,我们证明来自OSCC细胞的CM激活巨噬细胞,使其成为M1样表型,而使用来自癌前或正常上皮细胞的CM处理的巨噬细胞未观察到明显的功能变化。此外,在主要OSCC样本中检测到类似M1的TAM。我们发现巨噬细胞在早期阶段通过p38、Akt和SAPK/JNK信号途径摄取OSCC细胞释放的外显体而激活。此外,我们提供的证据表明,来源于OSCC外显体的THBS1参与巨噬细胞向M1样表型的激活。相反,来自外体激活巨噬细胞的CM显著促进OSCC细胞的恶性迁移。因此,我们提出了一种基于口腔鳞状细胞癌外体的癌细胞和巨噬细胞之间的新型旁分泌环。
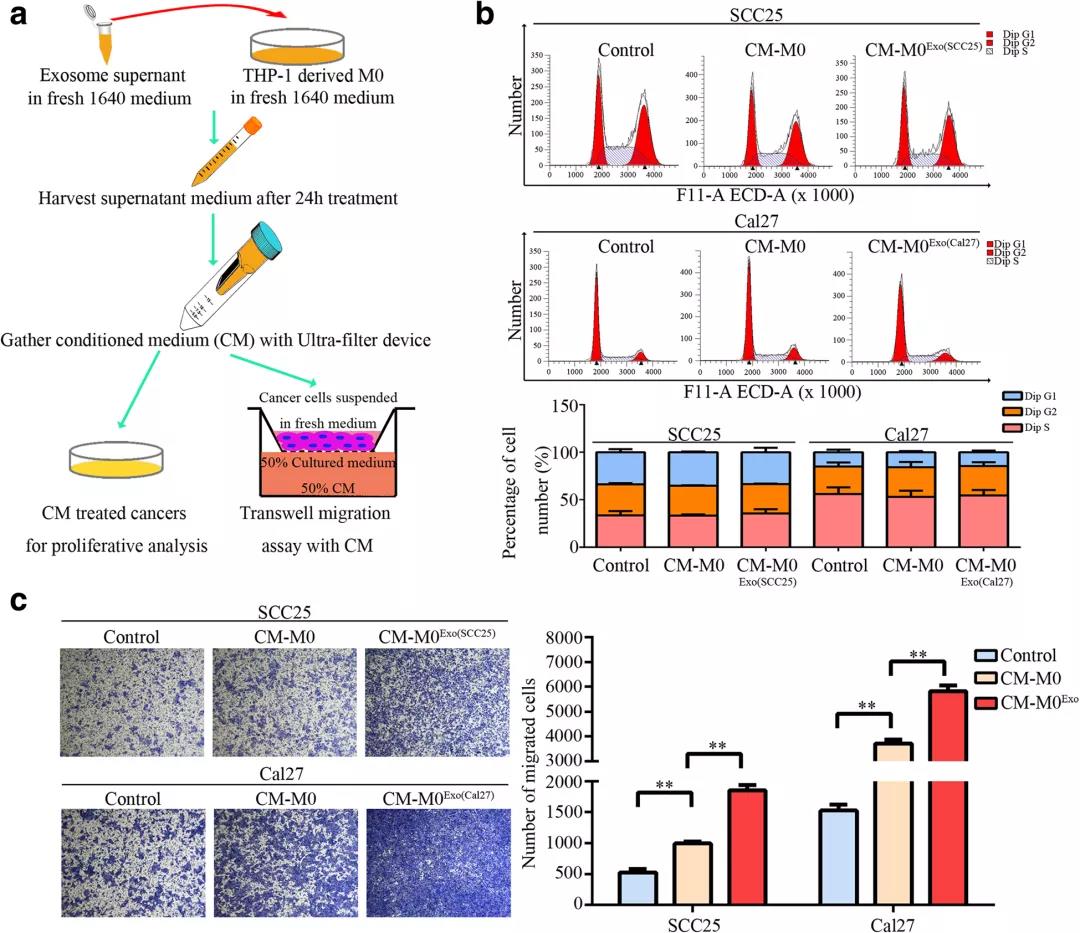
结论
癌细胞微环境中基于外显体的通讯是癌症发展过程中的一些关键事件。在这项研究中,作者探讨了CM中的外显体从OSCC激活巨噬细胞到M1样表型。
与正常上皮相比,在口腔鳞状细胞癌中THBS1的表达显著上调。研究还发现,与癌前和正常上皮细胞相比,OSCC细胞中THBS1的mRNA表达和分泌水平更高。此外,基于两个队列和THBS1基因敲除分析的生物信息学分析表明,THBS1表达水平与OSCC中M1激活密切相关。
 讨论
讨论
TAM的M1-M2转换发生在肿瘤进展过程中,但对M1/M2转换相关的潜在信号知之甚少。仍然需要进一步的研究来确定M1和M2样TAM在口腔鳞癌肿瘤微环境中共存的潜在机制。
详见LabEx网站( http://www.u-labex.com)或来电咨询!
基因水平:PCR Array
蛋白水平:MSD、Luminex、CBA、Antibody Array、ELISA
细胞水平:磁珠分选、流式细胞分析
组织水平:多重免疫组化、病理分析
联系电话:4008-168-068 转3
联系邮箱:labex@univ-bio.com
公众平台:多因子实验服务专家




