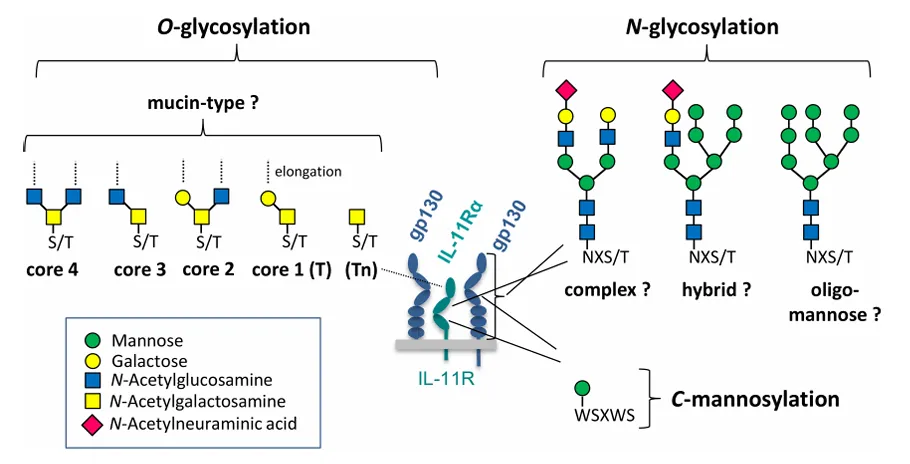
白细胞介素6(IL-6)作为一种多功能细胞因子,在免疫调节、炎症反应、细胞增殖分化及肿瘤发生发展等生理病理过程中发挥核心作用。糖基化作为IL-6关键的翻译后修饰方式,通过N-糖基化和O-糖基化两种形式,在不影响其基本信号功能的前提下,对其合成分泌、信号传导、体内稳定性及病理效应进行精细调控。
Kohrs L, Buettner FFR,. The biology of interleukin-6 family cytokines is regulated by glycosylation. Biochem J. 2025 May 21;482(10):535-551.
一、 IL-6的糖基化位点特征与修饰规律
IL-6的糖基化修饰具有明确的位点特异性和细胞类型相关性,其修饰模式与信号肽切割差异密切相关,构成了IL-6功能多样性的结构基础。
(一)N-糖基化位点:功能性修饰的核心区域
IL-6存在两个经实验证实的功能性N-糖基化位点——N73(天冬酰胺73)和N172(天冬酰胺172),这两个位点在人血单个核细胞、肺癌细胞等多种细胞分泌的IL-6中均能检测到糖链修饰。N-糖链的合成始于内质网,在高尔基体中完成进一步加工,形成唾液酸化复杂型、寡甘露糖型等多种结构类型,不同结构的糖链直接决定IL-6的功能特性。
(二)O-糖基化位点:保守的基础修饰
IL-6的O-糖基化位点相对单一,仅T170(苏氨酸170)被明确证实为修饰位点。尤为特殊的是,在肺癌细胞分泌的IL-6中,超过99%的分子在此位点携带单个O-糖链,且无论N-糖基化是否正常,O-糖基化均会稳定发生,提示其可能是IL-6的“基础修饰”,在蛋白结构稳定中发挥保底作用。
(三)糖基化模式与信号肽切割的关联
IL-6的糖基化修饰模式受信号肽切割差异调控,呈现出明显的结构分化:
N端为A28(丙氨酸28)的IL-6异构体:仅发生O-糖基化,缺乏N-糖链修饰;
N端为V30(缬氨酸30)的IL-6异构体:同时发生N-糖基化和O-糖基化,形成双修饰模式。
这一差异的分子机制目前尚未完全阐明,但为解释IL-6功能异质性提供了重要线索。
二、 N-糖基化对IL-6功能的核心调控作用
糖基化是调控IL-6生物学功能的主要修饰形式,其作用具有显著的细胞类型依赖性和糖链结构特异性,主要通过信号传导调控、体内稳定性调节及合成分泌调控三大途径实现功能干预。
(一)信号传导的双向调控:强度与通路的选择性调节
N-糖基化并非IL-6信号激活的必需条件,但能通过结构修饰影响信号传导的强度和下游通路选择:
1. 无显著影响场景:通过半合成技术在N73位点添加唾液酸化复杂型、寡甘露糖型等不同N-糖链的IL-6,与大肠杆菌表达的无糖基化IL-6相比,在Ba/F3-gp130-IL-6R细胞中诱导增殖的能力无差异,表明特定条件下N-糖链不影响IL-6与IL-6R/gp130受体复合物的结合及基础信号启动。
2. 信号增强场景:哺乳动物细胞(如CHO细胞)分泌的糖基化IL-6,对B9杂交瘤细胞的生长促进作用显著强于无糖基化IL-6;在大鼠发热模型中,糖基化IL-6诱导体温升高1℃的效能更优,提示糖基化可通过增强受体结合效率或信号放大效应提升IL-6的生物学活性。 3. 通路重编程场景:肺癌细胞分泌的N-糖基化缺陷IL-6(仅含O-糖基化),会导致STAT3激活时间缩短,并优先激活SRC-YAP-SOX2信号轴,而非正常的Jak/STAT通路。该异常通路会直接促进肿瘤细胞上皮-间质转化(EMT)、体外迁移及体内转移,揭示N-糖基化缺陷是IL-6获得促癌功能的关键分子基础。
(二)血浆半衰期调控:非典型的清除速率规律
IL-6的N-糖链结构直接决定其在体内的清除效率,且呈现与经典糖蛋白代谢不同的非典型规律:
普遍规律:多数N-糖基化IL-6的血浆清除速度慢于无糖基化IL-6,表明糖基化修饰可通过保护蛋白不被蛋白酶降解或减少受体介导的内吞,增强IL-6的体内稳定性;
特殊例外:末端含α2,6-唾液酸的N-糖链IL-6,其清除速度反而快于去唾液酸IL-6(N-糖链末端为半乳糖)。这与“唾液酸修饰延长蛋白半衰期”的经典认知相反,提示IL-6可能通过肝脏中特殊的受体(如半乳糖结合蛋白)介导清除,其糖链末端结构是调控清除速率的关键靶点。
(三)合成与分泌调控:折叠质控的重要环节
IL-6的N-糖基化发生于内质网和高尔基体的加工过程中,虽不直接阻断其分泌,但对蛋白折叠质控具有重要意义。研究发现,N-糖基转移酶基因表达降低会导致N-糖基化缺陷IL-6在细胞内积累,提示N-糖链的添加可能参与IL-6的正确折叠验证,未完成糖基化修饰的异常蛋白会被滞留于质控系统,避免功能异常分子的分泌。
三、 O-糖基化对IL-6的功能影响:辅助与协同作用
相较于研究较为深入的N-糖基化,IL-6的O-糖基化功能研究仍相对有限,但现有证据表明其在蛋白功能调控中发挥辅助作用:
修饰普遍性:O-糖基化不受N-糖基化状态影响,无论N-糖链是否存在,T170位点的O-糖基化均稳定发生,体现了其作为“基础修饰”的保守性;
功能冗余性:目前尚未发现O-糖基化直接影响IL-6的受体结合、信号激活或血浆半衰期。推测其可能与N-糖基化协同作用,通过增强蛋白空间结构稳定性、减少降解等方式辅助调控IL-6功能,但具体分子机制仍需进一步实验验证。
四、 糖基化修饰的病理意义与临床应用潜力
IL-6的糖基化状态与疾病发生发展密切相关,尤其在肿瘤等病理过程中扮演关键角色,为疾病诊断、预后评估及靶向治疗提供了新的分子靶点。
(一)疾病标志物潜力:N-糖基化缺陷
IL-6作为肿瘤转移标志物 研究证实,N-糖基化缺陷的IL-6通过激活异常SRC-YAP-SOX2信号轴,显著促进肺癌细胞转移,且该修饰缺陷型IL-6在肿瘤组织中的表达水平与患者转移风险、预后不良呈正相关。因此,检测IL-6的N-糖基化状态(如N73/N172位点修饰完整性)有望成为肺癌等肿瘤转移风险的潜在诊断标志物,为临床精准分期和治疗方案选择提供参考。
(二)靶向治疗新策略:针对糖基化修饰的干预方向
基于糖基化对IL-6功能的调控机制,可开发多维度靶向干预策略:
1. 糖基化修饰调控:通过调控N-糖基转移酶活性,恢复肿瘤细胞中IL-6的正常N-糖基化模式,阻断其促癌信号通路;
2. 糖链结构靶向:针对α2,6-唾液酸等特殊糖链结构,开发特异性结合分子,加速促癌型IL-6的体内清除;
3. 异构体靶向:设计针对A28型IL-6(仅O-糖基化)的特异性中和抗体,选择性清除促癌亚型,保留正常IL-6的生理功能。
(三)生物制药优化:糖基化工程提升IL-6相关药物效能
在IL-6靶向药物开发中,糖基化修饰可作为优化靶点:
对于IL-6拮抗剂(如单克隆抗体),可通过修饰抗体糖链结构(如去岩藻糖基化)增强抗体依赖的细胞毒性(ADCC)效应;
对于重组IL-6(用于炎症相关疾病治疗),可通过调控N-糖链的唾液酸化状态,优化其体内半衰期和生物活性,提升治疗效果。
五、 IL-6因子检测服务
IL-6 糖基化 “结构决定功能” 的核心规律已明确,但信号肽切割调控修饰模式、O/N - 糖基化协同机制、修饰动态变化的时空调控等关键问题仍待破解。这些研究需依托单细胞多组学、空间转录组等前沿技术深化探索。
LabEx 整合 30 + 技术平台,涵盖单细胞测序、空间多组学、多因子检测等核心技术,可提供从基因到组织水平的一站式服务。未来,依托 LabEx 专业技术支撑,IL-6 糖基化研究将向功能机制解析与临床转化深耕,为相关疾病诊断与治疗提供精准方案,助力炎症与肿瘤领域科研突破。
LabEx多款现货Panel支持IL-6因子检测,欢迎咨询!
| 中文名称 | 官网货号 (点击货号查看详情) |
技术平台 | 检测指标 |
| 人炎症10因子Panel | LXMH10-1 | MSD | IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-8,IL-10,IL-12p70,IL-13,TNF-α |
| 人炎症10因子Panel | LXLBH10-1 | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-6 ,IL-8/CXCL8,IL-10,IL-12 p70,IL-13,TNF-α,IFN-γ |
| 小鼠炎症10因子Panel | LXMM10-1 | Luminex | IFN-γ,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-10,IL-12p70,KC/GRO,TNF-α |
| 小鼠炎症10因子Panel | LXLBM10-1 | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |
| 大鼠炎症10因子Panel | LXLBR10-1 | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |
| 小鼠细胞因子-23因子Panel | LXLBM23-1 | Luminex | Eotaxin/CCL11,G-CSF,GM-CSF,IFN-γ,IL-10,IL-12(p40),IL-12(p70),IL-13,IL-17A,IL-1α,IL-1β,IL-2,IL-3,IL-4,IL-5,IL-6,IL-9,GRO-α (Gro-a/KC/CXCL1),MCP-1/CCL2,MIP-1α/CCL3,MIP-1β,RANTES,TNF-α |
| 大鼠细胞因子-23因子Panel | LXLBR23-1 | Luminex | G-CSF,GM-CSF,GRO/KC,IFN-γ,IL-1α,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-7,IL-10,IL-12 (p70),IL-13,IL-17A,IL-18,M-CSF,MCP-1,MIP-1α,MIP-3α,RANTES,TNF-α,VEGF |
| 小鼠趋化因子-31因子Panel | LXLBM31-1 | Luminex | BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Fractalkine/CX3CL1,GM-CSF,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,KC/CXCL1,MCP-1/CCL2,MCP-3/CCL7,MCP-5/CCL12,MDC/CCL22,MIP-1α/CCL3,MIP-1β/CCL4,MIP-3α/CCL20,MIP-3β/CCL19,RANTES/CCL5,SCYB16/CXCL16,SDF-1α/CXCL12,TARC/CCL17,TNF-α |
| 人细胞因子-46因子Panel | LXLRH46-1 | Luminex | CCL2/JE/MCP-1,CCL3/MIP-1 alpha,CCL4/MIP-1 beta,CCL5/RANTES,CCL11/Eotaxin,CCL19/MIP-3 beta,CCL20/MIP-3 alpha,CD40 Ligand/TNFSF5,CXCL1/GRO alpha/KC/CINC-1,CXCL2/GRO beta/MIP-2/CINC-3,CXCL10/IP-10/CRG-2,EGF,FGF basic/FGF2/bFGF,Flt-3 Ligand/FLT3L,G-CSF,GM-CSF,Granzyme B,IFN-alpha 2/IFNA2,IFN-beta,IFN-gamma,IL-1 alpha/IL-1F1,IL-1 beta/IL-1F2,IL-1ra/IL-1F3,IL-2,IL-3,IL-4,IL-5,IL-6,IL-7,IL-8/CXCL8,IL-9,IL-10,IL-12 p70,IL-13,IL-15,IL-17/IL-17A,IL-17E/IL-25,IL-33,Lymphotoxin-alpha/TNF-beta,PD-L1/B7-H1,PDGF-AA,PDGF-AB/BB,TGF-alpha,TNF-alpha,TRAIL/TNFSF10,VEGF |